

| 1 |
| 2 |
| 1 |
| 2 |
| Ksp(BaSO4) |
| C(SO42-) |
| 1×10-10 |
| 1×10-4 |
| Ksp(BaCO3) |
| C(Ba2+) |
| 2.5×10-9 |
| 1×10-6 |


科目:高中化学 来源: 题型:
| A、NaAlO2 |
| B、NaAlO2和NaOH |
| C、Al(OH)3 |
| D、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、微粒
| ||
| B、漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器用于物质分离 | ||
| C、非金属氧化物一定属于非电解质 | ||
| D、在熔化状态下能导电的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 碱性氧化物 | 强电解质 | 含氧酸 | 非电解质 |
| 属于该类的物质 | ① | NaOH | ② | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、实验室制氨气:NH4++OH-
| ||||
| B、向NaHCO3溶液中滴入少量澄清的石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | ||||
| C、酸性KMnO4溶液与H2O2反应:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | ||||
| D、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
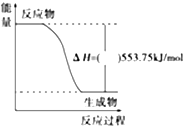 (1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com