
| A. | H+、HCO3-、Ca2+ | B. | Ba2+、H+、Cl- | C. | Ca2+、NH4+、HCO3- | D. | Mg2+、NH4+、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合加入过量氢氧化钠溶液并加热,既无沉淀又无气体生成来解答.
解答 解:A.H+、HCO3-结合生成水和气体,不能大量共存,故A错误;
B.该组离子之间不反应,可大量共存,且加入过量氢氧化钠溶液并加热,既无沉淀又无气体生成,故B正确;
C.该组离子之间不反应,可大量共存,但加入过量氢氧化钠溶液并加热,生成碳酸钙沉淀和氨气,故C错误;
D.该组离子之间不反应,可大量共存,但加入过量氢氧化钠溶液并加热,生成氢氧化镁沉淀和氨气,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:填空题
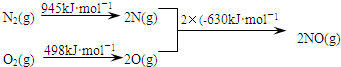
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向正反应方向移动,溶液中n(H+)增大 | |
| B. | 加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 序号 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| 1 | 0.3mol | 0.2mol | 0.1mol | - |
| 2 | 0.1mol | 0.3mol | - | 0.1mol |
| A. | 只有c(K+)相同 | B. | 只有c(Cl-)相同 | ||
| C. | 完全相同 | D. | 两种营养液功效不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类、油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 多饮用纯净水,少饮用矿泉水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物 氧化铁 FeO | B. | 酸性氧化物 碳酸气 CO2 | ||
| C. | 酸 硫酸 H2S | D. | 盐 纯碱 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com