
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
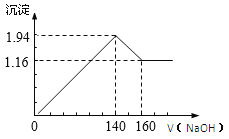
求:(1)合金中Mg,Al的质量_______________;
(2)所用HCl的物质的量浓度_______________。
【答案】m(Mg)=4.8 g,m(Al)=0.27 g 0.7 mol/L
【解析】
(1)由图可知,从加入氢氧化钠溶液就开始产生沉淀,加入氢氧化钠溶液为140 mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为NaCl,根据元素守恒可知n(HCl)=n(NaOH),利用NaOH的物质的量及溶液的体积计算HCl的物质的量,结合HCl的体积,利用物质的量浓度定义式计算盐酸的浓度;该阶段消耗氢氧化钠140 mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH);从加入氢氧化钠溶液140 mL~160 mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,利用该阶段中NaOH与Al(OH)3的物质的量,计算Al的物质的量和质量,结合总质量计算出原混合物中Al的质量。
(1)假设原混合物中Mg、Al的物质的量分别是x、y,沉淀最大值时Mg、Al形成的Mg2+、Al3+完全转化为Mg(OH)2和Al(OH)3,58x+78y=1.94g,在加入氢氧化钠溶液140 mL~160 mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,n(NaOH)=c·V=0.5 mol/L×0.02 L=0.01 mol,则n[Al(OH)3]=n(NaOH)=0.01 mol,n(Al)=0.01 mol,m[Al(OH)3]=0.01 mol×78 g/mol=0.78 g,根据Al元素守恒可知m(Al)=n·M=0.01 mol×27 g/mol=0.27 g;m[Mg(OH)2]=1.16g,n[Mg(OH)2]=![]() =0.02 mol,所以根据Mg元素守恒可知Mg的质量为m(Mg)=0.02 mol×24 g/mol=0.48 g;
=0.02 mol,所以根据Mg元素守恒可知Mg的质量为m(Mg)=0.02 mol×24 g/mol=0.48 g;
(2)加入氢氧化钠溶液为140 mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)= 0.5 mol/L×0.14 L=0.07 mol,根据氯元素守恒n(HCl)=0.07 mol,所以根据物质的量浓度定义式可得盐酸的物质的量浓度为c=![]() =0.7 mol/L。
=0.7 mol/L。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列表示式中,正确的是( )
A.醋酸的电离方程式:CH3COOH → CH3COO一+ H+
B.常温下NH4Cl溶液的pH < 7
C.因为SO3的水溶液能够导电,所以SO3是强电解质
D.在常温下的NaOH溶液中,由于NaOH抑制了水的电离,水的离子积常数(KW)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g)![]() CH3OH (g)。
CH3OH (g)。
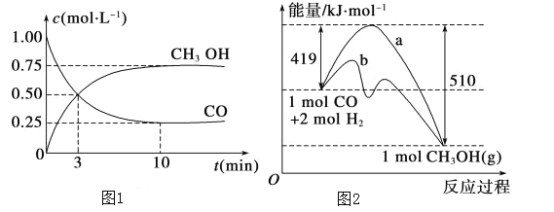
(1)该反应的平衡常数表达式为:K=______________________
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)=____________。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是________(填“吸热”或“放热”)反应,反应的热化学方程式是__________________________________________。
(4)适宜的催化剂能_______(选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有________(选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
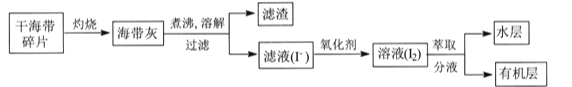
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )

A.浓硫酸B.NaOH溶液C.Kl溶液D.饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物R的结构简式如图,下面有关说法不正确的是( )

A.1molR与足量的Na反应能生成1molH2
B.1molR最多能消耗2molNaOH
C.R能发生取代反应、加成反应、氧化反应、还原反应等反应类型
D.1molR完全燃烧消耗16molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置.
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ |
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)__;元素⑤的原子结构示意图为___.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)______.
(3)写出元素⑧的单质与水反应的化学方程式:______.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应N2(g)+3H2(g)![]() 2NH3(g),达到平衡的标志是
2NH3(g),达到平衡的标志是
①反应速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2;②各组分的物质的量浓度不再改变;③体系的压强不变;④混合气体的密度不变 (相同状况);⑤体系的温度不再发生变化;⑥2 v(N2)(正)=v(NH3)(逆) ;⑦单位时间内有3mol H—H断裂同时有2mol N—H断裂。
A.①②③⑤⑥⑦B.②③④⑤⑥C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
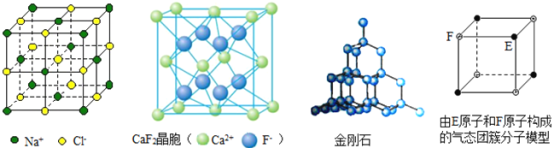
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com