

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |


科目:高中化学 来源: 题型:
| ① |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量的2mol?L-1盐酸,再滴加适量1mol?L-1 BaCl2溶液. | 有白色沉淀生成,证明待测溶液中含SO42- |
| 步骤② | ||
| 步骤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
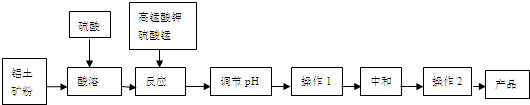
| n(MnO2) |
| n(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| 淀粉--混合物 | 液氯--非电解质 | 苯酚--有机物 | 水晶--分子晶体 |
| 胆矾--纯净物 | 碳酸钙--强电解质 | 纯碱--盐 | 食盐--离子晶体 |
| 盐酸--化合物 | 醋酸--弱电解质 | 水--氧化物 | 金刚石--原子晶体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com