
���� ��1������ʣ���ˮ��Һ�л�����״̬���ܹ�����Ļ����
�ǵ���ʣ�������״̬��ˮ��Һ�ж����ܵ���Ļ����
��2�����ӷ���ʽΪ��H++OH-�TH2O���ɱ�ʾǿ����ǿ�Ӧ���ɿ������κ�ˮ�����ӷ�Ӧ��
��3������̼���Ƽ��Ȳ��ֽ⣬̼�����Ƽ��ȷֽ�õ�̼���ơ�ˮ��������̼�����
��4������n=$\frac{V}{Vm}$��Ϸ��ӵĹ��ɼ��㣮
��5������n=$\frac{m}{M}$����Fe3+�����ʵ�������Һ��2n��SO42-��=3n��Fe3+�����ٸ���c=$\frac{n}{V}$����SO42-�����ʵ���Ũ�ȣ�
��6������������ʻᷢ���۳���
��7���������Һ��������ǿ��ȡ��������Ũ�ȵĴ�С����ˮ�м����������ݷ�Ӧ���������������ж�����Ũ�ȵı仯�����жϵ��������仯��
��� �⣺��1����Һ̬�Ȼ�����ˮ��Һ���ܵ��磬�ǵ���ʣ�
��NaHCO3��ˮ��Һ��������״̬���ܹ����磬�ǵ���ʣ�
�۹��崿����ˮ��Һ��������״̬���ܹ����磬�ǵ���ʣ�
����������ˮ��Һ������״̬�¶����ܹ����磬�Ƿǵ���ʣ�
��Ba��OH��2������״̬���ܵ��磬�ǵ���ʣ�
������������ˮ��Һ��������״̬���ܹ����磬�ǵ���ʣ�
�����������������ڻ���� �Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
�ఱˮ���ڻ���� �Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
��������ڻ���� �Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
����������Һ���ڻ���� �Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
�����ڵ���ʵ��ǣ��٢ڢۢޣ��ǵ���ʵ��У��ܢݣ�
�ʴ�Ϊ���٢ڢۢޣ��ܢݣ�
��2�����ӷ���ʽΪ��H++OH-�TH2O���ɱ�ʾǿ����ǿ�Ӧ���ɿ������κ�ˮ�����ӷ�Ӧ����HCl+KOH=H2O+KCl��
�ʴ�Ϊ��HCl+KOH=H2O+KCl��
��3������̼���Ƽ��Ȳ��ֽ⣬̼�����Ƽ��ȷֽ�õ�̼���ơ�ˮ��������̼�����Գ�ȥ���崿��������С�մ�IJ����Ǽ��ȣ�����ʽΪ��
�ʴ�Ϊ�����ȣ�2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
��4��n��CO2��=$\frac{1}{2}$n��O��=0.2mol��V��CO2��=0.2mol��22.4L/mol=4.48L��
�ʴ�Ϊ��4.48��
��5��Fe3+�����ʵ���Ϊ$\frac{5.6g}{56g/mol}$=0.1mol����Һ��2n��SO42-��=3n��Fe3+������SO42-�����ʵ���Ϊ0.1mol��$\frac{3}{2}$=0.15mol��SO42-�����ʵ���Ũ��Ϊ$\frac{0.15mol}{0.1L}$=1.5mol/L��
�ʴ�Ϊ��1.5mol/L��
��6�������������������л��������������أ����巢���۳��������������Dz������ɫ������
�ʴ�Ϊ���������ɫ������
��7����ˮ�е�һˮ�ϰ���������ʣ����ֵ�������������ƶ�������Ũ�Ƚ�С�����������Ӧ�����Ȼ����ǿ����ʣ���ȫ���룬��������Ũ������������������ǿ��
�ʴ�Ϊ����ǿ��
���� ���⿼�������ʵ��������������ʺͷǵ���ʵĸ����������ʣ����ӷ���ʽ��д�����ʵ����йؼ���ȣ���Ŀ�ۺ���ǿ�����������������ʵĿ����DZ�����ѵ㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����ͼ��ʾ�ĵ������Һ�ĵ�����װ���У�����ij-�������Һ����μ�����һ����Һʱ����ƹ������䰵��Ϩ������������ǣ�������
����ͼ��ʾ�ĵ������Һ�ĵ�����װ���У�����ij-�������Һ����μ�����һ����Һʱ����ƹ������䰵��Ϩ������������ǣ�������| A�� | ��������μ���ʳ����Һ | B�� | ��������μ�������������Һ | ||
| C�� | ����������Һ����μ���������Һ | D�� | ��������μ��백ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧ�� | C-H | C-C | C�TC | H-H |
| ����/kJ•mol-1 | 412 | 348 | 612 | 436 |
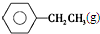 $\stackrel{����}{?}$
$\stackrel{����}{?}$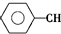 ��CH2��g��+H2��g���ķ�Ӧ�ȡ�HΪ��������
��CH2��g��+H2��g���ķ�Ӧ�ȡ�HΪ��������| A�� | -124 kJ/mol | B�� | +124 kJ/mol | C�� | -40 kJ/mol | D�� | +40 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��С�մ�NaHCO3����������������ͷ | |
| B�� | �����������Һ�Ⱦ���ʹ�������ɫ������ɫ | |
| C�� | ��Al��OH��3�������� | |
| D�� | ���ά����Ҫ�ɷ���SiO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������� | B�� | 1H��2H | ||
| C�� | ʯī�ͽ��ʯ | D�� | CH3CH2CH2CH3�ͣ�CH3��2CHCH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu�������� | B�� | HNO3�ڷ�Ӧ�б����� | ||
| C�� | ÿ����1 mol NOת��3 mol e- | D�� | HNO3�����ֳ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��H+��SO42-��OH- | B�� | Na+��Ca2+��CO32-��NO3- | ||
| C�� | Na+��H+��Fe2+��NO3- | D�� | Na+��Cu2+��Cl-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com