
判断下列反应的熵值增加的是( )
A.2H2(g)+O2(g)═2H2O(l)
B.H2(g)+Cl2(g)═2HCl(g)
C.(NH4)2 CO3(s)═NH4HCO3(s)+NH3(g)
CO3(s)═NH4HCO3(s)+NH3(g)
D.Cu(s)+Cl2(g)═CuCl2(s)
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A.生铁片发生吸氧腐蚀
B.中心区:Fe–2e—==Fe2+
C.边缘处:O2+2H2O+4e—==4OH—
D.交界处:4Fe2++O2+10H2O==4Fe(OH)3+8H+
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:选择题
下列有关金属的说法中,正确的是( )
①纯铁不容易生锈;②钠着火用水扑灭;③铝在空气中耐腐蚀,所以铝是不活泼金属;④缺钙会引起骨质疏松,缺铁会引起贫血;⑤青铜、不锈钢、硬铝都是合金;⑥KSCN溶液可以检验Fe3+
A.①④⑤⑥ B.②③④⑤ C.①③④⑤ D .①②⑤⑥
.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:填空题
合理应用和处理含氮的化合物,在生产生活中有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
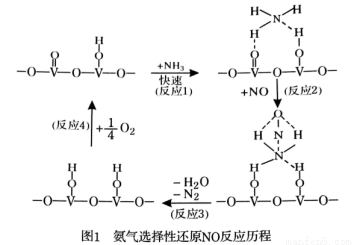
写出总反应化学方程式 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
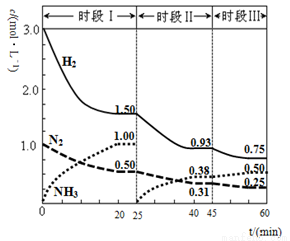
在2L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 。
25min时采取的措施是 。
③时段III条件下,反应的平衡常数表达式为 (只列计算表达式,不计算)。
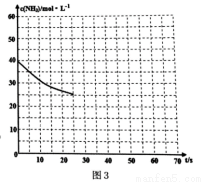
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:选择题
下列有关物质的分离说法正确的是
A.检查是否漏水是滴定管、容量瓶、分液漏斗等仪器使用的第一步操作
B.碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色
C.可用加热法分离NH4Cl(s)和I2(s)
D.蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
在HNO2溶液中存在如下平衡:HNO2?H++NO2﹣,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是
A.NaOH溶液 B.硫酸溶液 C.NaNO2溶液 D.NaHSO4溶液
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
化学平衡主要研究下列哪一类反应的规律( )
A.部分反应 B.任何反应 C.可逆反应 D.气体反应
查看答案和解析>>
科目:高中化学 来源:2017届山东省潍坊市临朐县高三12月阶段测化学试卷(解析版) 题型:填空题
硫及其化合物用途广泛,研究硫及其化合物性质和用途意义重大。
⑴利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+1/2O2(g) SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
①该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _________ v (逆)(填“<”、“>”或“=”)。
(逆)(填“<”、“>”或“=”)。
②该温度下,向一体积为2 L的恒容密闭容器中充入2.0 mol SO2和1.0 molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为_______________。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__________(填字母)。
A.保持 温度和容器体积不变,充入1.0 mol O2
温度和容器体积不变,充入1.0 mol O2
B.升高温度
C.保持温度和容器体积不变,充入1.0  mol SO3
mol SO3
D.增大容器体积
⑵室温下,Li /FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是___________________。
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产生物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等,请写出化学反应方程式:第一次放电:__________________;第二次放电:________________。
⑶制取高纯度黄铁矿的另一种方法是:以LiCl—KCl低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解,写出阳极方程式______________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期末化学试卷(解析版) 题型:实验题
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3 (aq)+S(s) Na2S2O3 (aq)
Na2S2O3 (aq)
实验步骤:
① 称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。 另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分夹持装置略去),水浴加热, 微沸60分钟。
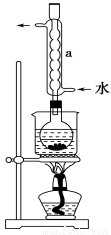
③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、低温干燥,得到产品。
回答问题:
(1) Na2S2O3 中硫元素的化合价为_____________;Na2S2O3在强酸性溶液中不能稳定存在,其原因为___________________(用离子方程式表示)。
(2)仪器a的名称是________,其作用是________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________。检验其是否存在的方法是___________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂, 用0.100 0 mol·L-1碘的标准溶液滴定(反应原理为:2S2O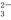 +I2===S4O
+I2===S4O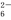 +2I-)。
+2I-)。
(4)滴定至终点时,溶液颜色的变化:_____________。
(5)滴定结束后消耗碘的标准溶液体积为20.00mL。产品的纯度为(用含W的代数式表示)_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com