
碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于盐酸转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解28.4g的上述混合物,消耗1.0mo?L-1盐酸l500mL。灼烧等量的上述混合物,得到的氧化铜质量是
A.15g B.20g C.30g D.35g
科目:高中化学 来源: 题型:

| 仪器 | 试管 | 干燥管 干燥管 |
洗气瓶 洗气瓶 |
| 药品 | 碱式碳酸铜 | 无水硫酸铜 无水硫酸铜 |
澄清石灰水 澄清石灰水 |
| △ |
| △ |
| ||
| ||
| 22400w-65V |
| 64V |
| 22400w-65V |
| 64V |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
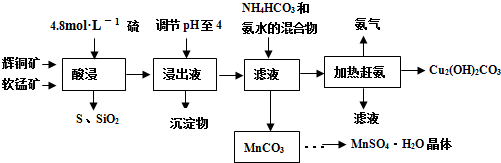
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
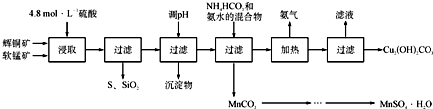
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe 3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
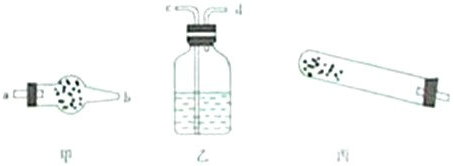
| ||
| ||
| 22400w-65V |
| 64V |
| 22400w-65V |
| 64V |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
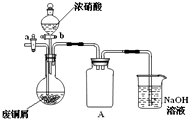 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com