
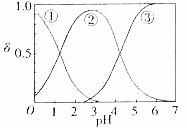
 草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.
草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.分析 (1)A、草酸是二元弱酸,分步电离;
B、NaHC2O4溶液显酸性是因为草酸氢根离子的电离程度大于水解程度;
C、草酸钠溶液显碱性说明草酸钠是强碱弱酸盐;
D、草酸是弱酸,草酸根离子与铵根离子水解相互促进;
(2)由图可知①代表的是H2C2O4、②代表的是HC2O4-③代表的是C2O42-,由此分析:
A、曲线①代表的粒子是H2C2O4;
B、由图可知,NaHC2O4溶液pH=3~4,证明溶液显示酸性,阴离子的电离程度大于其水解程度;
C、由图可知,pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4);
D、据物料电荷守恒分析;
(3)写出混合液中的电荷守恒c(H+)+c(K+)=2c(C2O42-)+c(OH-)+c(HC2O4-),结合已知关系②c(C2O42-)+2c(OH-)=2c(H+)+c(HC2O4-)+3c(HC2O4),将①×2+②可得:③c(K+)=3[c(C2O42-)+c(HC2O4)+c(HC2O4-)],从而证明K2C2O4和KHC2O4的物质的量相等,所以a=b.
解答 解:(1)A、草酸是二元弱酸,分步电离,故A错误;
B、NaHC2O4溶液显酸性是因为草酸氢根离子的电离程度大于水解程度,故B错误;
C、草酸钠溶液显碱性说明草酸钠是强碱弱酸盐,说明草酸是弱电解质,故C正确;
D、草酸是弱酸,草酸根离子与铵根离子水解相互促进,所以0.1mol•L-1(NH4)2C2O4洛液中的c(NH${\;}_{4}^{+}$)比0.1mol•L-1(NH4)2SO4溶液中的大,故D错误;
故答案为:C;
(2)A、曲线①代表的粒子是H2C2O4,故A错误;
B、NaHC2O4溶液pH=4,证明溶液显示酸性,阴离子HC2O4-的电离程度大于其水解程度,所以c(H2C2O4)<c(C2O42-),故B正确;
C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),故C错误;
D、据物料守恒可知c(Na+)?c(H2C2O4)+c(HC2O4-)+c(C2O42-),故D正确;
故答案为:BD;
(3)amol.L-1的K2C2O4溶液与bmol.L-1的KHC2O4溶液等体积混合,根据电荷守恒可得:①c(H+)+c(K+)=2c(C2O42-)+c(OH-)+c(HC2O4-),已知所得溶液中粒子浓度间的关系为:②c(C2O42-)+2c(OH-)=2c(H+)+c(HC2O4-)+3c(HC2O4),
将①×2+②可得:③c(K+)=3[c(C2O42-)+c(HC2O4)+c(HC2O4-)],
只有当K2C2O4和KHC2O4的物质的量相等时才能满足c(K+)=3[c(C2O42-)+c(HC2O4)+c(HC2O4-)],
所以两溶液中含有K2C2O4和KHC2O4的物质的量相等,又两溶液等体积混合,
所以两溶液的浓度相等,即:a=b,
故答案为:a=b.
点评 本题考查了离子浓度大小比较及其综合应用,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 酸的化学式 电离常数K | 氢硫酸 H2S | 亚硫酸 H2SO3 | 铬酸 H2CrO4 | 氰酸 HCN |
| K1 | 9.1×10-8 | 1.5×10-2 | 1.8×10-1 | 5.0×10-10 |
| K2 | 1.1×10-12 | 1.0×10-7 | 3.2×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/(min) | 2 | 4 | 6 | 8 |
| n(SO3)/(mol) | 4.2 | 8.0 | 9.4 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的元素(不考虑稀有气体的原子半径);Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的元素(不考虑稀有气体的原子半径);Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 简单离子半径:Z>X>W | |
| B. | 最简单气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW中既含离子键又含共价键 | |
| D. | Y的氧化物能与X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com