
| A. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 原子中核外电子排布的周期性变化是产生元素周期律的根本原因 | |
| D. | 核素就是同位素 |
分析 A.化学反应为原子重新组合的过程,存在化学键的断裂和形成;
B.化学键包括离子键和共价键;
C.元素周期率的实质为原子中核外电子排布的周期性变化;
D.根据同位素、核素的定义判断.
解答 解:A.化学反应为原子重新组合的过程,存在化学键的断裂和形成,所以化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程,故A正确;
B.化学键包括离子键和共价键,则可以使离子相结合,也可以使原子相结合,故B正确;
C.元素周期律就是元素性质的周期性变化规律,性质是有结构决定,所以元素周期律的实质就是原子核外电子的排布的周期性变化,故C正确;
D.核素是指的单一的原子,而同位素是同种元素的不同原子之间的互称,故D错误.
故选:D.
点评 本题考查较综合,涉及同位素、化学键及元素周期律等,注重基础知识的考查,注意把握问题的实质,题目难度不大.


科目:高中化学 来源: 题型:解答题
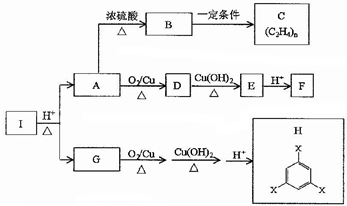
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH2=CH-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol•L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷(P4)易溶于CS2,但难溶于水 | B. | NaCl易溶于水,难溶于CCl4 | ||
| C. | 碘易溶于苯,微溶于水 | D. | 卤化氢易溶于水,也易溶于CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
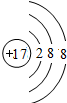 、
、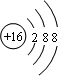 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

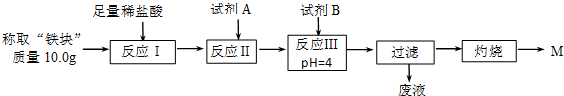
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com