
 ijʵ��С�������50 mL 1.0 mol/L�����50 mL 1.1 mol/L ����������Һ����ͼװ���н����кͷ�Ӧ���ڴ��ձ��ײ�������ĭ����(��ֽ��)��ʹ�����С�ձ���������ձ�������ƽ��Ȼ�����ڴ�С�ձ�֮����������ĭ����(��ֽ��)�����ձ�������ĭ���ϰ�(��Ӳֽ��)���ǰ壬�ڰ��м俪����С�ף�����ʹ�¶ȼƺͻ��β��������ͨ����ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��Իش��������⣺
ijʵ��С�������50 mL 1.0 mol/L�����50 mL 1.1 mol/L ����������Һ����ͼװ���н����кͷ�Ӧ���ڴ��ձ��ײ�������ĭ����(��ֽ��)��ʹ�����С�ձ���������ձ�������ƽ��Ȼ�����ڴ�С�ձ�֮����������ĭ����(��ֽ��)�����ձ�������ĭ���ϰ�(��Ӳֽ��)���ǰ壬�ڰ��м俪����С�ף�����ʹ�¶ȼƺͻ��β��������ͨ����ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��Իش��������⣺
��1����ʵ�������Թ�����NaOH��ԭ��̲���˵��Ϊ��֤������ȫ���к͡����ʣ������ڷ�Ӧ������Ϊ�з�������������������ڷ�Ӧ�лӷ������õ��к���____________(�ƫ����ƫС�����䡱)��
��2�����к��Ȳⶨʵ���д�����ˮϴ���¶ȼ��ϵ�����IJ��裬���˲������裬���õ��к��Ȼ�____________(�ƫ����ƫС�����䡱)��
��3�����õ�Ũ�ȵĴ�����NaOH��Һ��Ӧ�����õ��к��Ȼ�____________(�ƫ����ƫС�����䡱)����ԭ����_______________________________________________��
��4����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50 mL������¼��ԭʼ����(���±�)��
| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�(t2)/�� | �²�(t2��t1)/�� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.00g/cm3���кͺ���Һ�ı�����c��4.18��10��3kJ/(g����)����÷�Ӧ���к���Ϊ��H��______ __�����ݼ�������д�����кͷ�Ӧ���Ȼ�ѧ����ʽ_______________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
AΪҩ���л����A�����ɷ�����ͼ��ʾ��һϵ�з�Ӧ����֪A��һ���������ܸ�������������Ӧ��A�����б����ϵ�����ȡ�����������ڵ�̼ԭ���ϣ�D���ܸ�NaHCO3��Һ��Ӧ�����ܸ�NaOH��Һ��Ӧ��

��ش�
��1��Aת��ΪB��Cʱ���漰���ķ�Ӧ������ _____��_______________��
��2��E��һ��ͬ���칹��Q����һ�������·���������Ӧ��Ҳ����Na��Ӧ�ų�H2Q�ṹ��ʽΪ______��
��3��D�Ľṹ��ʽΪ__________________��
��4����֪���������뺬���ǻ������ʷ�Ӧ�����������ʡ����磺
 д�������ȣ�����ʽC2O2Cl2��
д�������ȣ�����ʽC2O2Cl2��
���ӽṹʽ�� ���������л���D��Ӧ�����ջ�ѧ����ʽ
���������л���D��Ӧ�����ջ�ѧ����ʽ
_______________________________________________________________��
��5����֪��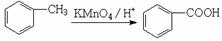
���ڼ����ӡ����м������л���A����ѡ����ȷ�м����(��B��C) ��������ԭ�� ��
B: C:
C:
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����е����������Ӧʱ�����ı䷴Ӧ�������¶ȡ���Ӧ�������ȣ�����ѧ��Ӧ�����ı����
A��Na��O2 B��H2S��O2
C��Fe��FeCl3 D��AlCl3��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ҹ�ij����н����ļ���ν������ꡣ�ݻ������Ųⶨ���ó��������ļ������pHƽ��Ϊ3.2�������ֻ����е�����Ʒ���ױ���ʴ���Դ����������ĸ�ʴ����������ȷ����
A���˸�ʴ�����л�ѧ��ʴҲ�е绯ѧ��ʴ
B�������绯ѧ��ʴʱ��������ӦΪ2H2O��O2��4e��=4OH��
C���ڻ�ѧ��ʴ����������������
D�������绯ѧ��ʴʱ�ĸ�����ӦΪ��e=Fe2++2e��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ᡢ���ᡢ��������ᶼ��ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣�������±������ж�����˵����ȷ����
| �� | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6��10-5 | 6.3��10-9 | 1.6��10-9 | 4.2��10-10 |
A���ڱ������ˮ���������ᶼû����ȫ����
B���ڱ������и�������������������������
C���ڱ�����������ĵ��뷽��ʽΪH2SO4=2H+��SO42-
D��ˮ�������������ǿ��û����������������������������������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڷ�ӦCO(g)��H2O(g) CO2(g)��H2(g)����H ��0����������������������(����)
CO2(g)��H2(g)����H ��0����������������������(����)
A������������ı��˷�Ӧ��;������Ӧ�Ħ�HҲ��֮�ı�
B���ı�ѹǿ��ƽ�ⲻ�����ƶ�����Ӧ�ų�����������
C�������¶ȣ���Ӧ���ʼӿ죬��Ӧ�ų�����������
D������ԭ����н��У���Ӧ�ų�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ء�������������Ļ����Һ�У���pH=1,c(Al3+)=0.3mol��L-1��c(SO42��)=0.6mol��L-1
��c(K+)�� ��
A��0.15 mol��L-1 B��0.2 mol��L-1 C��0.3 mol��L-1 D��0.4 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�»���2009��10��15�ձ�����ȫ��ũ��Ӧ���ڡ���ɫ��̬��������ʡ���̼���ܡ�ѭ����չ�������������£����ø���ط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����衣�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺
(1)ú��������Һ���������ȼ�ϵ������ʡ�
��֪25 �棬101 kPaʱ��C(s)�� O2(g)===CO(g) ��H����126.4 kJ��mol��1
O2(g)===CO(g) ��H����126.4 kJ��mol��1
2H2(g)��O2(g)===2H2O(l)����H����571.6 kJ��mol��1
H2O(g)===H2O(l)����H����44 kJ��mol��1
����25 �桢101 kPaʱ��C(s)��H2O(g)===CO(g)��H2(g)����H��______________��
(2)��¯������CO�������Ҫ��;֮һ���������ӦΪFeO(s)��CO(g) Fe(s)��CO2(g)����H>0����֪��1100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��0.263��
Fe(s)��CO2(g)����H>0����֪��1100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��0.263��
���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��ʱƽ�ⳣ��Kֵ________(���������С�����䡱)��
��1100��ʱ��ø�¯�У�c(CO2)��0.025 mol��L��1��c(CO)��0.1 mol��L��1��������������£��÷�Ӧ�Ƿ��ڻ�ѧƽ��״̬��________(��ǡ���)�����ж�������______ ��
(3)Ŀǰ��ҵ�Ͽ���CO2������ȼ�ϼ״����йط�ӦΪCO2(g)��3H2(g)  CH3OH(g)��H2O(g)����H����49.0 kJ��mol��1���������Ϊ1 L���ܱ������г���1 mol CO2��3 mol H2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)��H2O(g)����H����49.0 kJ��mol��1���������Ϊ1 L���ܱ������г���1 mol CO2��3 mol H2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��

�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=����������������������
�����д�ʩ��ʹ  �������������(�����)��
�������������(�����)��
A�������¶� B���ٳ���H2 C���ٳ���CO2
D����H2O(g)����ϵ�з��� E������He(g)��ʹ��ϵѹǿ����
(4)CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2
��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ����������ĵ��볣�����£�
| ����Ļ�ѧʽ | CH3COOH | HCN | H2S |
| ���볣����25�棩 | 1.8��10-5 | 4.9��10-10 | K1��1.3��10-7 K2��7.1��10-15 |
25��ʱ������˵����ȷ���ǣ� ��
A�������ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH(CH3COONa)> pH(Na2S) > pH(NaCN)
B��a mol/LHCN��Һ��b mol/LNaOH��Һ�������ϣ�������Һ��c(Na+)>c(CN-)����aһ������b
C��NaHS��Na2S�Ļ����Һ�У�һ������c(Na+)��c(H+)��c(OH-)��c(HS-)��2c(S2-)
D��ijŨ�ȵ�NaCN��Һ��pH��d����������ˮ�������c(OH-)��10-dmol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com