
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案_____________________;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为_________kJ;
(3)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
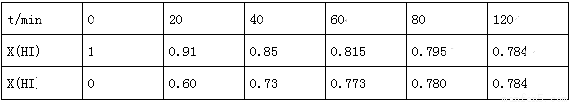
①根据上述实验结果,该反应的平衡常数K的计算式为:______________;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向_______(填“正”或“逆”)反应方向移动,达到平衡后x(HI)_______(填“增大”、“减小”或“不变”)。
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为_______(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=________min-1.
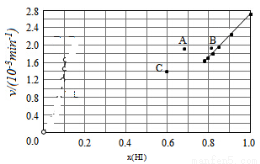
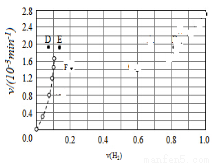
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为__________(填字母)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:填空题
NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将NO2 转化为重要化工原料C。

若A为NO2,B为O2,则负极的电极反应式为______________________________;
(2)有一种用CO2生产甲醇燃料的方法:
CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
H2O(g)=H2O(l) △H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_________________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)  COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
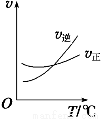

①0~6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7min 向体系中加入这三种物质各2mol,则平衡向____________________
移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、c(COCl2)_________ mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是__________;(填“增大”、“减小”或“不变”)
⑤比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)_______T(15)(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.10mol·L-1的浓氨水:Al3+、NH4+、NO3-、I-
C.与Al反应放出H2的溶液:Mg2+、Ca2+、NO3-、HCO3-
D.c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
设 NA为阿伏加德罗常数的数值,下列说法错误的是( )
A.已知 N2 (g)+3H2 (g) 2NH3(g) △H =-92.4 kJ·mol-1,当有 1molNH3时,上述反应的 △H 变为-46.2 kJ·mol-1
2NH3(g) △H =-92.4 kJ·mol-1,当有 1molNH3时,上述反应的 △H 变为-46.2 kJ·mol-1
B.1mol 羟基(—OH)与 17gNH3所含电子数都为NA
C.由 8.0gCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为0.1NA
D.常温常压下,7.1gCl2与足量的Fe粉反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:选择题
短周期X、Y、Z、W四种元素在元素周期表中位置如图所示。有关表述正确的是( )
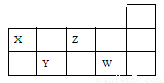
A. X、Y、W的最高价氧化物对应水化物均属强酸
B. Y的氢化物能与Y的最高价氧化物对应水化物反应
C. 原子半径从大到小依次为X>Z>Y>W
D. Z的氢化物的沸点低于W的氢化物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:推断题
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式为_____ _,元素D与E形成的酸式盐的电子式:___ __。
(2)元素的非金属性C、E的强弱比较,下列各项中,能说明这一结论的事实有_____(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。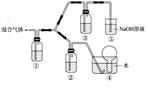
已知(ⅰ) 浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ) NaOH溶液与BC2反应的化学方程式为:2NaOH+2BC2═NaBC2+NaBC3+H2O ;NaOH溶液与BC气体不反应。
a.装置①、②中盛放的药品依次是______、______。
b.能够说明实验已成功的现象是 __ ____。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高二6月小班成果验收化学卷(解析版) 题型:选择题
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥ C.③④⑥ D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com