
| A. | 浓盐酸 | B. | Na2SO4浓溶液 | C. | NaOH浓溶液 | D. | Ba(OH)2浓溶液 |
分析 HCO3-在溶液中存在电离平衡,HCO3-?CO32-+H+,使HCO3-数目减少,CO32-数目增加,增大平衡正向移动,据此进行分析.
解答 解:A.加入HCl,碳酸根离子与氢离子反应生成碳酸氢根离子,导致HCO3-离子增加,CO32-离子减少,故A错误;
B.加入Na2SO4溶液,对平衡HCO3-?CO32-+H+无影响,故B错误;
C.加入NaOH,HCO3-?CO32-+H+正向移动,HCO3-的数目减少,CO32-数目增加,故C正确;
D.加入0.5molBa(OH)2溶液,0.5mol钡离子消耗0.5mol碳酸根离子,而1mol氢氧根离子恰好将1mol碳酸氢根离子转化成1molCO32-,导致HCO3-的数目减少,CO32-数目增加,故D正确;
故选CD.
点评 本题考查离子反应,题目难度不大,注意Na2CO3和NaHCO3的性质的异同,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:实验题
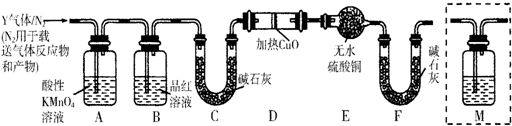
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石、白磷都属于单质 | |
| B. | 漂白粉、碱石灰都属于纯净物 | |
| C. | 氯化铵、亚硫酸都属于强电解质 | |
| D. | 氧化钠、过氧化钠都属于碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol A2的同时生成n mol AB | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | A2、B2、AB的物质的量浓度之比为1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu和Zn | B. | Na和Ag | C. | Fe和Ca | D. | Cu和Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3水解:HSO3-+H2O?SO32-+H3O+ | |
| B. | 向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S+2Cl- | |
| C. | AlCl3溶液中滴加浓氨水至过量:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2既是氧化剂也是还原剂 | |
| B. | CuSO4在反应中被还原 | |
| C. | 14 mol CuSO4氧化了1 mol FeS2 | |
| D. | 被还原的S和被氧化的S的质量之比为3:7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com