
|
��һ�������£����ܱ��������Ѵ�ƽ��״̬�Ŀ��淴Ӧ��NO2��CO | |
| [����] | |
A�� |
�ӿ�ʼ��Ӧ���ﵽƽ��״̬��������ѹǿʼ�ձ��ֲ��� |
B�� |
�ڵ���ƽ��ʱ��NO2��CO2��NO��CO�����ʵ�������� |
C�� |
ƽ����ϵ�������ܵ����ʵ������ڿ�ʼ��Ӧʱ��ϵ�������ܵ����ʵ��� |
D�� |
�ﵽƽ��ʱ��NO��CO2�����ʵ���֮�Ϳ��ܵ���NO2��CO�����ʵ���֮�� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
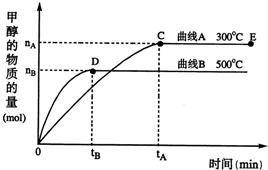 �������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���һ�������£������Ϊ3L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����
�������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���һ�������£������Ϊ3L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO���� CH3OH��g��
CH3OH��g��| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2| ��ȼ |
| ��ȼ |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�����л�ѧ�������ᣩ��������ʦ�������Ծ��� ���ͣ�021
���������У���ȷ����
[����]
A��ijһ�ض��Ŀ��淴Ӧ�У�ֻҪ�����������䣬�����Ƿ�ʹ�ô�����ƽ��ʱ�����Ũ������һ����
B��![]() ������
������![]() �Ƿ��ȷ�Ӧ�������¶ȣ��淴Ӧ�������ӣ�����Ӧ���ʼ��٣�ƽ�������ƶ�
�Ƿ��ȷ�Ӧ�������¶ȣ��淴Ӧ�������ӣ�����Ӧ���ʼ��٣�ƽ�������ƶ�
C�������巴Ӧ��˵����ѹǿ��һ����ʹ��ѧƽ�ⷢ���ƶ�
D�����1mol![]() ��3mol
��3mol![]() ��һ�������£����ܱ������з�Ӧ���ﵽƽ��ʱ���Ȼ����2mol
��һ�������£����ܱ������з�Ӧ���ﵽƽ��ʱ���Ȼ����2mol![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�021
���������У���ȷ����
[����]
A��ijһ�ض��Ŀ��淴Ӧ�У�ֻҪ�����������䣬�����Ƿ�ʹ�ô�����ƽ��ʱ�����Ũ������һ����
B��![]() ������
������![]() �Ƿ��ȷ�Ӧ�������¶ȣ��淴Ӧ�������ӣ�����Ӧ���ʼ��٣�ƽ�������ƶ�
�Ƿ��ȷ�Ӧ�������¶ȣ��淴Ӧ�������ӣ�����Ӧ���ʼ��٣�ƽ�������ƶ�
C�������巴Ӧ��˵����ѹǿ��һ����ʹ��ѧƽ�ⷢ���ƶ�
D�����1mol![]() ��3mol
��3mol![]() ��һ�������£����ܱ������з�Ӧ���ﵽƽ��ʱ���Ȼ����2mol
��һ�������£����ܱ������з�Ӧ���ﵽƽ��ʱ���Ȼ����2mol![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��11�֣��о�ȼ�ϵ�ȼ�պͶ���Ⱦ���������������������ڷ�ֹ������Ⱦ����Ҫ���塣
��1����úת��Ϊ�������ȼ�ϣ�
��֪��H2(g)+1/2O2(g)=H2O(g)
 H= −241��8kJ/mol
H= −241��8kJ/mol
C(s)+1/2O2(g)=CO(g)  H= −110��5kJ/mol
H= −110��5kJ/mol
д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ ��
��2��һ�������£����ܱ������ڣ�SO2��������SO3���Ȼ�ѧ����ʽΪ��2SO2(g)+O2(g)  2SO3(g)��
2SO3(g)��
��H=−a kJ/mo1������ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������
A��4mo1 SO2��2mol O2���������� B��4mol SO2��2mo1 O2��2mol SO3
C��4mol SO2��4mo1 O2������ D��6mo1 SO2��4mo1 O2
��3������β����NOx��CO�����ɼ�ת����
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)  2NO(g)
2NO(g)
 H��0
H��0
��һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����
A��ѹǿ���� B���������ƽ����Է�����������
C��2v��(N2)��v��(NO) D�� N2������������ٸı�
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)
 H��0��
H��0��
�����������ܷ�ʵ�ֵ����� ��
��4��ȼ��CO��H2��һ�������¿����ת����CO(g)��H2O(g)  CO2(g)��H2(g)����420��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��CO��H2O��Ũ�Ⱦ�Ϊ0��1mol/L����CO�ڴ˷�Ӧ�����µ�ת����Ϊ
��
CO2(g)��H2(g)����420��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��CO��H2O��Ũ�Ⱦ�Ϊ0��1mol/L����CO�ڴ˷�Ӧ�����µ�ת����Ϊ
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com