
| A. | ZnCl2 | B. | CuCl2 | C. | FeCl2 | D. | NaCl |
科目:高中化学 来源: 题型:解答题
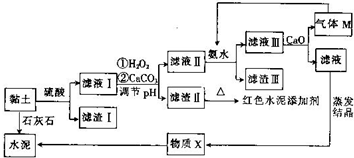 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫(SO2) | B. | 总悬浮颗粒物(TSP) | C. | 二氧化氮(NO2) | D. | 二氧化碳(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤<④<③<①<② | B. | ②<①<③<④<⑤ | C. | ⑤<④<②=③<① | D. | ⑤<③<④<②<① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质一定是钠的化合物 | B. | 该物质一定含钠元素 | ||
| C. | 该物质一定是单质钠 | D. | 能确定是否含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
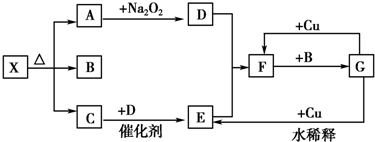
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n值为2 | |
| B. | 氧化产物与还原产物的物质的量比为2:5 | |
| C. | n值为3 | |
| D. | 氧化性R2O8n->MnO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com