
依据Mg、Al单质的性质,思考回答下列问题。
(1)铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能?
(2)Al既能溶于强酸,又能溶于强碱,所以说“Al既有金属性,又有非金属性”你认为这种说法是否恰当?为什么?
(3)铝与酸、碱反应的实质是什么?氧化剂是什么?
(4)镁在空气中充分燃烧,所得固体产物可能有哪些:________________(用化学式表示)。
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目小于0.1 NA
B.30g甲醛中含电子对数为4NA
C.12 g石墨烯(单层石墨)中含有六元环的个数是0.5NA
D.室温下,7.1 g氯气与足量石灰乳充分反应转移电子数小于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
| X | Y | ||
| Z | W | Q |
A.钠与Y可能形成Na2Y2化合物
B.Z的最高价含氧酸比X的最高价含氧酸的酸性强
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
Ni、K和F三种元素组成的一个化合物的晶胞如右图所示。该化合物的化学式及Ni的配位数为( )
A.K2NiF4;6 B.K4Ni2F8;8 C.K2NiF3;4 D.K2NiF6;6

查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E为短周期主族元素,它们的原子序数依次增大。请回答下列问题。
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D | 元素的主族序数与周期数的差为3 |
| E | 元素是该周期电负性最大的元素 |
(1)B基态原子中能量最高的电子,其电子云在空间有 个伸展方向,原子轨道呈 形。B与A能形成多种形式的化合物,其中BA5属于离子晶体,其电子式为 。
(2)C的单质在一种常见的非金属氧化物中剧烈燃烧生成黑、白两种固体,写出该反应的化学方程式 ;其中的白色固体可用作耐火材料,它属于 晶体。
(3)BE3 在常温下是一种淡黄色的液体,构成其晶体的微粒之间的作用力是 ,它遇水即发生水解可生成一种具有漂白性的物质,写出反应的化学方程式 ,该反应说明其中B和E中非金属性较强的是 (填元素的符号)。
(4)DO2气体通入足量Ba(BO3)2的溶液,生成白色沉淀和无色气体,有关反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某氧化物X难溶于水,能与烧碱反应,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中无沉淀生成,则X是 ( )
A.SiO2 B.Al2O3
C.MgO D.CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
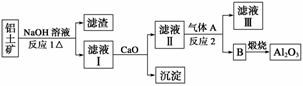
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

回答下列问题:
(1)写出反应1的化学方程式_______________________________________________。
(2)滤液Ⅰ中加入CaO生成的沉淀是________,反应2的离子方程式为____________。
(3)E可作为建筑材料,化合物C是________,写出由D制备冰晶石的化学方程式________________________________________________________________________。
(4)电解法制铝的化学方程式是________,以石墨为电极,阳极产生的混合气体的成分是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,电极2、4、6均为石墨电极。通电一段时间后,电极5质量增加2.16 g,请回答:
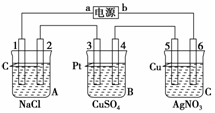
(1)电源b是_______极;A池中反应的离子方程式为:
(2)电极6的电极反应式:
(3)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为 mo1/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com