
【题目】请按要求回答下列问题:
(1)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如右图所示。
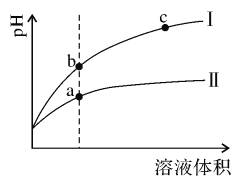
①稀释醋酸时pH值变化曲线是:___________(填:“I”或“Ⅱ”),
②b点溶液的导电性比c点溶液的导电性:___________(填:“强”、“弱”或“无法比较”),
③a、c两点Kw的数值相比,a___________c(填:“大于”、“小于”或“等于”),
(2)NH4Al(SO4)2在食品、医药、电子工业中用途广泛。
①NH4Al(SO4)2可做净水剂,其理由是:___________(用离子方程式表示)。
②相同条件下,0.1mol/L NH4Al(SO4)2溶液中,c(NH4+)___________0.1mol/L NH4HSO4溶液中c(NH4+)(填“大于”、等于”或“小于”)。
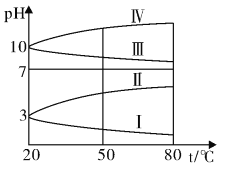
③下图是0.1mo/LNH4Al(SO)2溶液的pH随温度变化的图像,其中符合0.1mo/LNH4Al(SO4)2溶液的曲线是____ (填字母)。导致溶液pH随温度变化的原因是:_________________________________。
【答案】II 强 等于 Al3++3H2O![]() Al(OH)3(胶体)+3H+ 小于 I 升温使NH4Al(SO4)2水解平衡向正反应方向移动,酸性增强,pH降低
Al(OH)3(胶体)+3H+ 小于 I 升温使NH4Al(SO4)2水解平衡向正反应方向移动,酸性增强,pH降低
【解析】
(1)①根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度;
②利用c点、b点溶液中的离子浓度来分析导电性;
③K w 只与温度有关,与溶液的种类以及浓度大小没有关系;
(2)①Al3+水解生成的Al(OH)3胶体具有吸附性;
②NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
③NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大。
(1)①根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线;
②溶液导电性取决于离子浓度,b点的H + 浓度大,导电性强;
③Kw只与温度有关,与溶液的种类以及浓度大小没有关系,所以a、c两点Kw的数值相等;
故答案为:II;强;等于;
(2)①Al3+水解生成的Al(OH)3胶体具有吸附性,离子方程式为Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体能吸附悬浮颗粒使其沉降从而净化水,
Al(OH)3(胶体)+3H+,Al(OH)3胶体能吸附悬浮颗粒使其沉降从而净化水,
故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
②NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,则浓度相同的NH4Al(SO4)2溶液和NH4HSO4溶液中,NH4+浓度较大的是NH4HSO4溶液,故NH4Al(SO4)2溶液中c(NH4+)小于NH4HSO4溶液,
故答案为:小于;
③NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:Ⅰ;升温使NH4Al(SO4)2水解平衡向正反应方向移动,酸性增强,pH降低。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:_______。
②最外层电子数等于次外层电子数的元素原子:______。
(2)现有粒子:1H、35Cl、2H、14N、2H37Cl,其中:
①有_________种元素;
②__________之间互称同位素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A.Al2O3+6HCl=2AlCl3+3H2O
B.Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D.SiO2+2NaOH=Na2SiO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1) 同温同压下,同体积的NH3和H2S气体的质量比是________________;同质量的NH3和H2S气体的体积比是_____________,同质量的NH3和H2S气体中所含氢原子个数比是_____________,若两者所含氢原子个数相等,它们的物质的量比是__________;
(2)在100ml Al2(SO4)3溶液中含0.6molSO42-,从中取出1/4 体积的该溶液再稀释到100 ml,则稀释后的溶液中SO42-的物质的量浓度为_______________。。
(3)在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4∶3时,则Mg2+与SO42-物质的量浓度之比为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对图中的表述中正确的是( )
A.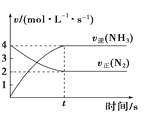 图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
B. 图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
C.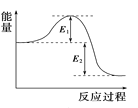 图可表示某化学反应属于放热反应,放出的能量为E1+E2
图可表示某化学反应属于放热反应,放出的能量为E1+E2
D.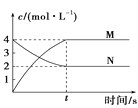 图涉及的反应可能为N(aq)2M(aq)
图涉及的反应可能为N(aq)2M(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液均为2L同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
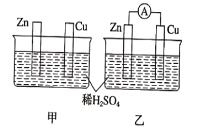
(1)以下叙述中,正确的是_______(填字母)
A.甲溶液中H+会向锌片移动
B.两烧杯中锌片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.甲中锌片是负极,乙中铜片是正极
E.乙的内电路中电流方向Zn→溶液→Cu
(2)实验时,甲、乙同时开始反应,0~15分钟内,测得甲中锌片质量减少了19.5克,乙中收集到氢气13.44升(已转化为标准状况),则用硫酸浓度的变化表示甲乙两装置的反应速率分别为:v(甲)=_________ mol·L-1·min-1,v(乙)=_________ mol·L-1·min-1,v(甲)___v(乙)(填>,<或 =),主要原因是__________。
(3)变化过程中能量转化的主要形式:甲为 _________;乙为____________。
(4)在乙实验中,如果把硫酸换成硝酸银溶液,请写出铜电极的电极反应方程式:_______,此时乙装置中正极的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。请根据下图中的合成路线回答下列问题:
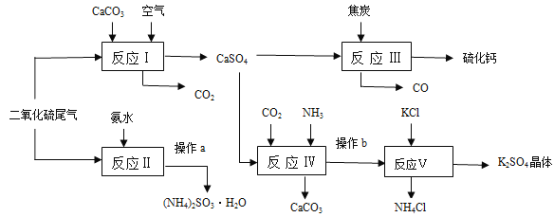
(1)生产中,常向反应II的溶液中加入强还原性的对苯二酚等物质,目的是__________。
(2)操作a中,必须的操作步骤有_______________、___________、过滤等。
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________。
(4)写出反应Ⅳ的化学方程式__________________________________________________;操作b所得滤液中阳离子的检验方法是________________。
(5)该生产过程中可以循环使用的物质是_______________。
(6)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________________________。
(7)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏[M(CaSO4·2H2O)=172],且反应过程中96%的二氧化硫转化为石膏,则可生产石膏______ t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com