
 ,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族,
,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族, ;第3周期,第VIA族;
;第3周期,第VIA族; 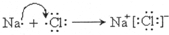 ,
, ;
;
| ||
| ||
 Al(OH)3﹢3H+,
Al(OH)3﹢3H+, Al(OH)3﹢3H+;
Al(OH)3﹢3H+;

科目:高中化学 来源: 题型:
| A、当可逆反应进行到平衡状态时,正向反应速率和逆向反应速率都为零 |
| B、平衡状态是一种静止的状态,因为反应物和生成物浓度都不再改变 |
| C、化学反应的限度不可以通过改变反应条件而改变 |
| D、当可逆反应达到平衡时,这个反应达到最大限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


 ,模仿如图所示流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)
,模仿如图所示流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | 基态原子核外p能级电子总数比s能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球生物的“保护伞” |
| W | 含量位居地壳中金属元素的第二位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出高热值的煤炭气,主要成分是CO和H2.
科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出高热值的煤炭气,主要成分是CO和H2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com