
【题目】为将混有K2SO4、MgSO4的KNO3固体提纯,并制得KNO3溶液,某学生设计了如下实验方案:

(1).操作①为__________。
(2).操作②~④所加试剂的溶质依次为__________。
(3).如何判断SO42-已除尽?__________。
(4).实验过程中产生的多种沉淀__________(填“需要”或“不需要”)多次过滤,其理由是__________。
(5).该同学的实验设计方案是否严密?__________(填“严密”或“不严密”),请说明理由:__________.
【答案】加水溶解Ba(NO3)2、KOH、K2CO3静置,取上层澄清溶液加入少量Ba(NO3)2溶液,若不变浑浊,则表明SO42-已除尽不需要几个生成沉淀的反应互不干扰,因此最后只需过滤一次,可减少操作步骤不严密加入盐酸调节溶液的pH会引进Cl- ,应加入稀硝酸调节pH
【解析】
由流程可知,混有K2SO4、MgSO4的KNO3固体溶解,配制成溶液,先加氢氧化钾溶液,除去镁离子,生成氢氧化镁沉淀,再加硝酸钡溶液,除去硫酸根,生成硫酸钡沉淀,再加碳酸钾,除去多余的钡离子,过滤除去沉淀得到滤液,在滤液中加入硝酸,除去多余的碳酸钾和氢氧化钾,硝酸易挥发,加热煮沸,制得纯净的KNO3溶液,加入盐酸调节溶液的pH会引进Cl-,以此解答该题。
(1)由流程可知,操作①为(加水)溶解,配制成溶液;
(2)由于过量的硝酸钡需要利用碳酸钾除去,所以碳酸钾一定要在硝酸钡的后面,则操作②~④加入的试剂依次为Ba(NO3)2、K2CO3、KOH或KOH、Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3;
(3)硫酸钡不溶于水也不溶于酸,则判断SO42-已除尽的实验操作为取少许滤液,先加入盐酸酸化,再向其中加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽;
(4)实验过程中产生的多次沉淀不需要多次过滤,因生成的沉淀可一次性过滤,如果分步过滤会使操作复杂化;
(5)根据以上分析可知该同学设计实验不合理,因调节溶液的pH不能用盐酸,而应该用硝酸,否则会引入杂质Cl-。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是

A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)S2﹣中含有 18 个电子,画出 S 的原子结构示意图_____.
(2)一水合氨(NH3H2O)是一种弱电解质,在水中可电离出铵根离子和氢氧 根离子,试写出一水合氨的电离方程式_____.
(3)正长石的组成可表示为 KAlSi3Ox,试根据化合价计算 x=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2Cl﹣
Cu2++2Cl﹣
B. 铅蓄电池放电时,负极增重:Pb﹣2e﹣+SO42﹣=PbSO4
C. 向碳酸钠溶液中滴加酚酞时,溶液变红:CO32﹣+2H2OH2CO3+2OH﹣
D. 明矾可用于净水:Al3++3H2OAl(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是合成某药物的中间体,X的结构简式为: 以有机物A为原料合成X的流程如图所示(部分条件省略):
以有机物A为原料合成X的流程如图所示(部分条件省略):

(1)步骤①的反应类型为____。
(2)D分子中官能团的名称是____ 。
(3)步骤⑥中E的结构简式为_______;碳酸钠的作用是_________。
(4)1mol B最多可消耗H2的物质的量为______mol。
(5)利用 可制备某线性结构高分子酚醛树脂,该反应的化学方程式为____。
可制备某线性结构高分子酚醛树脂,该反应的化学方程式为____。
(6)满足下列条件![]() 的同分异构体有____种。
的同分异构体有____种。
①苯环上有三个取代基;
②能发生银镜反应;
③能与碳酸氢钠溶液反应放出二氧化碳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
B. 6.4gCu与足量浓硝酸反应生成NO2分子数目为NA
C. 1mol淀粉(C6H10O5)n水解后产生的葡萄糖分子数目为NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________________。
(2)在容积为1L的密闭容器中,投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
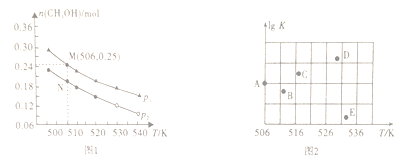
①该反应的△H_____0(填“>”、“<”或“=”),判断理由是_______________。
②M点时,CO的转化率为________。506K时该反应的平衡常数K=________(保留三位小数)。
③某同学绘制的压强为p时,不同温度下上述反应的平衡常数的对数值(lgK)如图2所示。A、B、C、D、E五点中能正确表示该反应的lgK与温度(T)的关系的点为____________。
④下列叙述能说明反应CO(g)+2H2(g) ![]() CH3OH(g)达到平衡状态的是________(填序号)。
CH3OH(g)达到平衡状态的是________(填序号)。
A.单位时间内生成2molH2的同时消耗1molCO
B.反应过程中c(CO):c(CH3OH)=1:1
C.恒温恒容时,混合气体的密度保持不变
D.绝热恒容时,反应的平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 12.4gP4中所含共用电子对总数为0.4NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目为0.1NA
C. 标准状况下,19gH218O2中所含电子总数为9NA
D. 1molSO2与0.5molO2在容积为V的容器中充分反应后转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com