
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物的水化物的酸性:Z>X | D. | Y、Z的简单离子均能抑制水的电离 |
分析 W原子在周期表中原子半径最小,则W为H元素;
X的最高正价与最低负价代数和为2,则X最外层含有5个电子,为ⅤA族元素,可能为N、P元素;
X与Y原子最外层电子数之和为8,则Y原子最外层电子数为:8-5=3,为ⅢA族元素,由于Y的原子序数大于X,则X为N元素、Y为Al元素;
Z原子的最外层电子数是Y原子最外层电子数的2倍,则Z最外层含有6个电子,Z的原子序数大于Y,则Z为S元素;
据此结合元素周期律知识进行解答.
解答 解:W原子在周期表中原子半径最小,则W为H元素;X的最高正价与最低负价代数和为2,则X最外层含有5个电子,为ⅤA族元素;X与Y原子最外层电子数之和为8,则Y原子最外层电子数为:8-5=3,为ⅢA族元素,由于Y的原子序数大于X,则X为N元素、Y为Al元素;Z原子的最外层电子数是Y原子最外层电子数的2倍,则Z最外层含有6个电子,Z的原子序数大于Y,则Z为S元素,
A.X为N、Y为Al,对应单质分别为氮气、Al,铝的沸点大于氮气,即:X<Y,故A错误;
B.W为H、Y为Al,对应离子为氢离子、铝离子,氢离子能够将铝氧化成铝离子,则氧化性氢离子大于铝离子,即:W>Y,故B正确;
C.X为N元素、Z为S元素,S对应的含氧酸有硫酸、亚硫酸,没有指出最高价,无法比较氧化物的水化物的酸性大小,故C错误;
D.Y为Al、Z为S元素,对应离子为铝离子、硫离子,铝离子和硫离子都能够结合水电离的氢离子或氢氧根离子,促进了水的电离,故D错误;
故选B.
点评 本题考查了原子结构与元素周期表的关系,题目难度中等,正确推断各元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ SO42- OH- | B. | Ca2+K+ HCO3-OH- | ||
| C. | Na+ H+ CH3COO- SO42- | D. | Ba2+ K+NO3-Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将等体积的①、②溶液混合后,盐酸会抑制醋酸的电离,所以pH>2 | |
| B. | 将一定体积的②、③溶液混合后,溶液显碱性,则该混合溶液中c(Cl-)>c(NH4+) | |
| C. | 将一定体积的①、④溶液混合后,溶液显酸性,则V(NaOH)可能等于V(CH3COOH) | |
| D. | 向等体积的③、④溶液中加水稀释10倍,稀释后溶液中由水电离的c(H+):③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,46gNO2和N2O4的混合气体中含有NA个氮原子 | |
| B. | 1mol12C18O2中所含的中子数为26NA | |
| C. | 常温下,1L0.1mol/LCH3COONa溶液中含有CH3COO-和Na+总数为0.2NA | |
| D. | 常温下,1LpH=12的氨水中含有OH-的数目为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用无水酒精萃取碘水中的碘 | |
| B. | Na2O2粉末加人到FeSO4溶液中.产生白色沉淀,并放出大量气泡 | |
| C. | 将浓氨水滴加到碱石灰中可制得氨气,也可用碱石灰干燥氨气 | |
| D. | 往酸性KMnO4溶液中通人SO2验证SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
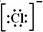 ;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.
;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
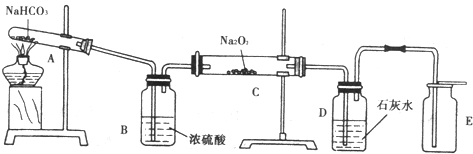
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com