
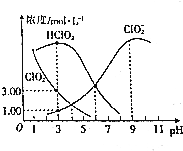
 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | HClO2的电离平衡常数Ka=10-6 | |
| C. | pH=3时,c(Cl-)>c(ClO2-) | |
| D. | pH=4时,c(Cl-)+c(ClO2-)-c(Na+)=10-4-10-10 |
分析 A、由图可以得出:碱性条件下ClO2-浓度高;
B、HClO2的电离平衡常数K=$\frac{c({H}^{+})c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$结合图示数据来计算;
C.酸性溶液中氯离子和ClO2-发生氧化还原反应生成氯气,结合氧化还原反应电子守恒计算分析;
D.PH=4的溶液中存在电荷守恒,结合溶液中离子积常数计算氢氧根离子浓度,代入计算分析判断;
解答 解:A、由图可以得出:碱性条件下ClO2-浓度高,即在碱性条件下亚氯酸钠较稳定,故A正确;
B、HClO2的电离平衡常数K=$\frac{c({H}^{+})c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$=10-3×10-3=10-6,故B正确;
C.PH=3溶液显酸性,图象可知生成ClO23mol/L,1L溶液中3ClO2-~3ClO2~3e-,ClO2-~Cl-~4e-,溶液中生成Cl-物质的量$\frac{3}{4}$mol,此时剩余ClO2-为1mol,则c(Cl-)<c(ClO2-),故C错误;
D.c(H+)+c(Na+)=c(ClO2-)+c(OH-)+c(Cl-),pH=4时,c(H+)=10-4mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,c(Cl-)+c(ClO2-)-c(Na+)=10-4-10-10,故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断,题目难度稍大,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向pH=4的溶液中滴加BaCl2溶液,会有白色沉淀产生 | |
| B. | pH=4.5时c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | pH=5时c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | |
| D. | 向pH=5.5的溶液中滴加溴水,反应的离子方程式为H2SO3+Br2+H2O=4H++SO42-+2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
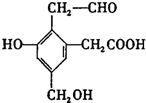 某有机物A结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
某有机物A结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )| A. | 6:4:6 | B. | 4:6:5 | C. | 2:3:2 | D. | 2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 反应物 | 催化剂 | 温度 |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol/LFeCl3溶液 | 40℃ |
| A. | 实验④反应速率最快 | |
| B. | 实验①反应速率最慢 | |
| C. | 实验②速率小于实验④的速率,只是因为实验④加入了催化剂 | |
| D. | 加入催化剂,能增大活化分子百分数,从而加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com