ij»Æ¹¤³§ŅŌČķĆĢæó”¢ÉĮŠææó£Ø³żÖ÷ŅŖ³É·ÖĪŖMnO
2”¢ZnSĶā»¹ŗ¬ÓŠÉŁĮæµÄFeS”¢CuS”¢Al
2O
3µČĪļÖŹ£©ĪŖŌĮĻÖĘČ”ZnŗĶMnO
2£®
£Ø1£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«ÕāĮ½ÖÖæó·ŪŌŚĮņĖįČÜŅŗÖŠĻą»„×÷ÓĆ£¬ÅäĘ½ČēĻĀµÄ»Æѧ·½³ĢŹ½£ŗMnO
2+FeS+H
2SO
4=MnSO
4+Fe
2£ØSO
4£©
3+S+H
2O
£Ø2£©½«ĖłµĆŗ¬ÓŠMn
2+ӢFe
3+ӢCu
2+ӢAl
3+ӢZn
2+µÄĖįŠŌČÜŅŗ°“ČēĶ¼¼×µÄ¹¤ŅµĮ÷³Ģ½ųŠŠ²Ł×÷“¦ĄķµĆČÜŅŗ£ØIV£©£¬µē½āČÜŅŗ£ØIV£©¼“µĆMnO
2ŗĶZn£®
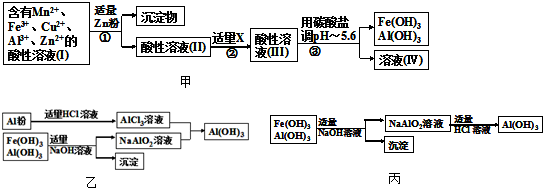
a”¢²Ł×÷¢ŁÖŠ¼ÓZn·Ūŗó·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ
Zn+Cu2+=Zn2++Cu£»Zn+2Fe3+=Zn2++2Fe2+
Zn+Cu2+=Zn2++Cu£»Zn+2Fe3+=Zn2++2Fe2+
£®
b”¢²Ł×÷¢ŚÖŠ¼ÓČėŹŹĮæXµÄ×÷ÓĆŹĒŹ²Ć“
½«Fe2+Ńõ»Æ³ÉFe3+
½«Fe2+Ńõ»Æ³ÉFe3+
£»XµÄŹ×Ń”ĪļµÄ»ÆѧŹ½ŹĒ£ŗ
MnO2
MnO2
£®
c”¢²Ł×÷¢ŪÖŠĖł¼ÓĢ¼ĖįŃĪµÄ»ÆѧŹ½ŹĒ
MnCO3»ņZnCO3»ņMnCO3ŗĶZnCO3
MnCO3»ņZnCO3»ņMnCO3ŗĶZnCO3
£®
£Ø3£©ĪŖĮĖ“ÓÉĻŹöĮ÷³ĢÖŠ²śÉśµÄFe£ØOH£©
3”¢Al£ØOH£©
3³Įµķ»ģŗĻĪļÖŠ»ŲŹÕAl£ØOH£©
3£¬¹¤³§Éč¼ĘĮĖČēĶ¼ŅŅµÄÓŠ¹ŲĮ÷³ĢĶ¼£®
aӢAlCl
3ČÜŅŗŗĶNaAlO
2ČÜŅŗ·“Ӧɜ³ÉAI£ØOH£©
3µÄĄė×Ó·½³ĢŹ½ĪŖ
Al3++3AlO2-+6H2O=4Al£ØOH£©3
Al3++3AlO2-+6H2O=4Al£ØOH£©3
£®Čō×ܹ²µĆµ½n molAl£ØOH£©
3£¬ŌņĻūŗĵÄNaOHŗĶHClµÄĄķĀŪĮæ£Ømol£©·Ö±šĪŖ
Ӣ
£®
b”¢ČōŹ¹ÓĆČēĶ¼±ūĮ÷³Ģ»ŲŹÕ“¦Ąķ£¬Ēė±Č½ĻĮ½øöĮ÷³ĢĻūŗÄĖį¼īµÄÓĆĮæ£æ
Čē°“±ūĮ÷³Ģ£¬ŌņµĆµ½Ķ¬ŃłnmolAl£ØOH£©3£¬ĻūŗĵÄNaOH”¢HClµÄĄķĀŪĮæ·Ö±šĪŖnmol£¬“óÓŚĒ°Į÷³ĢµÄĻūŗÄĮ棬Ļą¶Ō¶ųŃŌ£¬Ē°Į÷³Ģøü·ūŗĻ½ŚŌ¼µÄŌŌņ
Čē°“±ūĮ÷³Ģ£¬ŌņµĆµ½Ķ¬ŃłnmolAl£ØOH£©3£¬ĻūŗĵÄNaOH”¢HClµÄĄķĀŪĮæ·Ö±šĪŖnmol£¬“óÓŚĒ°Į÷³ĢµÄĻūŗÄĮ棬Ļą¶Ō¶ųŃŌ£¬Ē°Į÷³Ģøü·ūŗĻ½ŚŌ¼µÄŌŌņ
£®

 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø





 »ņ
»ņ »ņ
»ņ »ņ
»ņ
 »ņ
»ņ »ņ
»ņ »ņ
»ņ
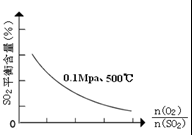 £Ø1£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬ŌŚŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ£¬½«SO2ŗĶO2»ģŗĻ·¢Éś·“Ó¦£ŗ
£Ø1£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬ŌŚŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ£¬½«SO2ŗĶO2»ģŗĻ·¢Éś·“Ó¦£ŗ