
【题目】[化学——选修3:物质结构与性质]
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

【答案】(1)1s22s22p63s23p63d104s24p3(2) 大于 小于 (3)三角锥形 sp3
(4)GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高;
(5)原子晶体;共价键![]()
【解析】
试题分析:(1)As为ⅤA族33号元素,电子排布式为:1s22s22p63s23p63d104s24p3。故答案为:1s22s22p63s23p63d104s24p3;
(2)根据元素周期律,Ga与As位于同一周期,Ga原子序数小于As,故半径Ga大于As,同周期第一电离能从左到右,逐渐增大,故第一电离能Ga小于As。
故答案为:大于;小于;
(3)AsCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,所以原子杂化方式是sp3,由于有一对孤对电子对,分子空间构型为三角锥形。
=4,所以原子杂化方式是sp3,由于有一对孤对电子对,分子空间构型为三角锥形。
故答案为:三角锥形;sp3;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高。
故答案为:GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高;
(5)GaAs的熔点为1238℃,熔点较高,以共价键结合形成属于原子晶体,密度为ρ gcm-3,根据均摊法计算,As:8×1/8+6×1/2=4,Ga:4×1=4,故其晶胞中原子所占的体积V1=(![]() πr3As×4+
πr3As×4+![]() πr3Ga×4)×10-30,晶胞的体积V2=
πr3Ga×4)×10-30,晶胞的体积V2=![]() =
=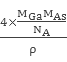 ,故GaAs晶胞中原子的体积占晶胞体积的百分率为
,故GaAs晶胞中原子的体积占晶胞体积的百分率为![]() ×100%将V1、V2带入计算得百分率=
×100%将V1、V2带入计算得百分率=![]() 。
。
故答案为:原子晶体;共价;![]()


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则B极的电极反应式为______________。
(2)若开始时开关K与b连接,则B极的电极反应式为__________,总反应的离子方程式为____________。
(3)若开始时开关K与b连接.下列说法正确的是_______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
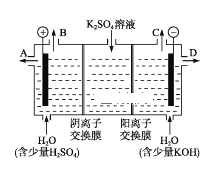
①该电解槽的阳极反应式为________。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制1 molL﹣1的NaOH溶液450 mL。请回答下列问题:
(1)计算:需要称取NaOH固体__g。
(2)配制时,必须使用的仪器有托盘天平(带砝码)、药匙、烧杯、玻璃棒、量简,还缺少的仪器是__、__。(填仪器名称)
(3)在使用容量瓶前必须进行的一步操作是__。
(4)实验两次用到玻璃棒,其作用分别是:先用于__、后用于__。
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是__(填字母)。
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.天平砝码生锈
C.配制过程中遗漏了洗涤步骤
D.未冷却到室温就注入容量瓶
E.加蒸馏水时不慎超过了刻度线
F.定容观察液面时俯视
(6)若实验过程中出现(5)中D这种情况你将如何处理?__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是______________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为______。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4)F 的化学名称是______,由F生成G的化学方程式为______。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44 gCO2,W共有______种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________。
(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)是一种黄色气体,熔点-64.5℃,沸点-5.5℃,易水解。它可以由C12与NO在常温常压下合成。请回答下列问题:

(1)制取原料气体NO、Cl2。其装置如图所示:
①装置a的名称是____________。
②制备干燥、纯净Cl2时,B装置中试剂是__________。
③制备NO时A装置中烧瓶内发生反应的化学方程式是_________________________。
(2)制备NOC1所需要的装置如图所示:

①正确的连接顺序为a→_______→_______→_______→_______→_______。
②已知NOC1分子中各原子都满足8e-稳定结构,其电子式为__________。
③向装置III中首先通人的气体是_________(填Cl2或NO),其目的是__________。
④装置IV中无水氯化钙的作用是______________。
⑤写出V中亚硝酰氯发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=c(CO2) c(H2)/(CO) c(H2O),在不同的温度下该反应的平衡常数值分别为:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态
D. 某温度下,如果平衡浓度符合下列关系式: c(CO2)/3(CO)=c(H2O)/5 c(H2),判断此时的温度1000℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
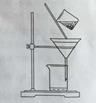
a. 漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
CaCO![]() 滤液
滤液![]()
![]() 白色晶体
白色晶体
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4— (绿色)、Cr2O72— (橙红色)、CrO42— (黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_____。
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应__________。
②由图可知,溶液酸性增大,CrO42-的平衡转化率____(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为_____。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6mol电子,则有1molCr2O72-被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com