
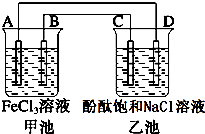
 如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:
如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:分析 甲池中电池反应式为2Fe3++Cu=2Fe2++Cu2+,反应过程中A电极质量逐渐减小,则A为Cu电极,发生氧化反应,B为石墨电极或活泼性较铜弱的金属,乙池为电解池,C为阳极,D为阴极,电解饱和食盐水生成氢气、氯气和氢氧化钠,以此解答该题.
解答 解:(1)反应过程中A电极质量逐渐减小,则A为Cu电极,发生氧化反应,为原电池负极,
故答案为:负; Cu;氧化;
(2)乙池为电解池,C为阳极,D为阴极,电解饱和食盐水生成氢气、氯气和氢氧化钠,阴极生成氢气和氢氧化钠,滴加酚酞变红色,电解方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2NaOH,
故答案为:产生无色无味的气体,溶液变红;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2NaOH;
(3)A电极质量减少0.64g时,n(Cu)=$\frac{0.64g}{64g/mol}$=0.01mol,转移0.02mol电子,C电极上产生的气体为氯气,则应生成0.01mol氯气,在标准状况下的体积为 2.24L,根据电极反应2H20+2e-═H2↑+2OH-,可知此时乙池中电解液的c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol/L,pH为 13.
故答案为:2.24;13.
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析、计算能力的考查,注意把握明确原电池正负极的判断方法是解本题关键,把握电解方程式的书写,难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 丙烷最多6个原子处于同一平面 | |
| B. | 环己烷最多有12个原子处于同一平面上 | |
| C. | 苯乙烯最多有16个原子处于同一平面上 | |
| D. | CH3CH=CH-C≡C-CF3最多有10个原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| B. | “酸可以除锈”,“汽油可以去油污”都是发生了化学变化 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.25mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
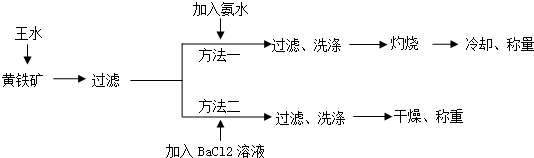
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | Na2SO3和H2O2的反应为氧化还原反应 | |
| C. | 若某反应的反应物总能量低于生成物总能量,则该反应为放热反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
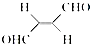 ,下列叙述正确的有AD.
,下列叙述正确的有AD.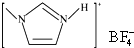 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
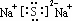 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com