
分析 (1)根据n=$\frac{N}{NA}$计算离子的物质的量,由电子和离子的物质的量之比求出电荷数;根据离子个数与质子数、中子数之比求出质子数、质量数.
(2)根据反应物和生成物写出相应的反应方程式.
解答 解:(1)根据n=$\frac{N}{NA}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,离子和电子的物质的量之比为0.1mol:0.3mol=1:3,物质的量之比等于微粒个数之比,所以一个离子是由该原子失去三个电子生成的,故电荷数为3;离子数与质子数、中子数之比为=6.02×1022个:6.02×1.3×1023个:6.02×1.4×1023个=1:13:14,所以该离子中含有13个质子、14个中子,故A为27,Z=A-N=27-14=13;
答:Z、n和A的值分别为:13、3、27;
(2)通过(1)知,该元素是Al,铝与NaOH溶液反应生成偏铝酸钠和氢气,所以化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
答:该金属与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
点评 本题考查了有关阿伏伽德罗常数的计算和化学反应方程式的书写,难度不大,明确物质的量之比等于微粒个数之比是解本题的关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 材料 | 主要化学成分 | |
| A | 水泥 | 硅酸盐 |
| B | 光导纤维 | 二氧化硅 |
| C | 碳素钢 | 铁碳合金 |
| D | 漂白液 | 次氯酸钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;化合物BA4的电子式为
;化合物BA4的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
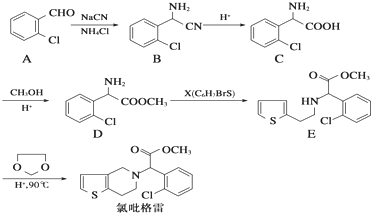 ,
, .
.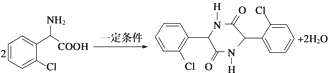 .
.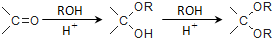 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物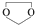 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物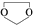 的最后一步反应
的最后一步反应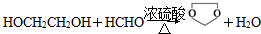 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{y}^{m}$X | B. | ${\;}_{y}^{y+m}$X | C. | ${\;}_{y+n}^{m+y+n}$X | D. | ${\;}_{y+n}^{y+m-n}$X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
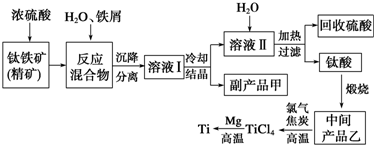
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com