
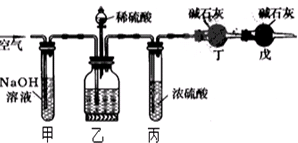
·ÖĪö £Ø1£©Ėłŗ¬ŌŖĖŲ»ÆŗĻ¼Ū½µµĶµÄ·“Ó¦ĪļĪŖŃõ»Æ¼Į£¬Ėłŗ¬ŌŖĖŲ»ÆŗĻ¼ŪÉż½µµÄ·“Ó¦ĪļĪŖ»¹Ō¼Į£¬¾Ż“Ė½įŗĻŌŖĖŲ»ÆŗĻ¼ŪÅŠ¶Ļ£»
£Ø2£©Ņ»Ńõ»ÆµŖŗĶŅ»Ńõ»ÆĢ¼¾¹żÅÅĘų¹ÜÖŠµÄ“ß»Æ×Ŗ»ÆĘ÷×Ŗ»ÆĪŖ¶Ō“óĘųĪŽĪŪČ¾µÄĪļÖŹ£¬Ó¦Éś³ÉµŖĘų”¢¶žŃõ»ÆĢ¼£»
£Ø3£©Ī²ĘųÖŠ¶žŃõ»ÆµŖŗ¬ĮæĪŖ1”Į106”Į0.5%=0.5”Į104L£¬½įŗĻ·“Ó¦µÄ»Æѧ·½³ĢŹ½¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©²śĪļNaNO2ÖŠNŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+3£¬ŌŚ·“Ó¦¢ŁÖŠ£¬Ńõ»Æ¼ĮŹĒNO2£¬»¹Ō¼ĮŹĒNO£¬ĖłŅŌŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄÖŹĮæÖ®±ČĪŖ46£ŗ30=23£ŗ15£¬ŌŚ·“Ó¦¢ŚÖŠ£¬Ö»ÓŠNŌŖĖŲ»ÆŗĻ¼Ū·¢Éś±ä»Æ£¬NŌŖĖŲ»ÆŗĻ¼Ū·Ö±šÓÉ+4¼ŪÉżøßµ½+5¼Ū”¢½µµĶµ½+3¼Ū£¬NO2¼ČŹĒŃõ»Æ¼ĮÓÖŹĒ»¹Ō¼Į£¬¹Ź“š°øĪŖ£ŗ+3£¬23£ŗ15£¬¶žŃõ»ÆµŖ£¬¶žŃõ»ÆµŖ£»
£Ø2£©Ņ»Ńõ»ÆµŖŗĶŅ»Ńõ»ÆĢ¼¾¹żÅÅĘų¹ÜÖŠµÄ“ß»Æ×Ŗ»ÆĘ÷×Ŗ»ÆĪŖ¶Ō“óĘųĪŽĪŪČ¾µÄĪļÖŹ£¬Ó¦Éś³ÉµŖĘų”¢¶žŃõ»ÆĢ¼£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ2NO+2CO$\frac{\underline{\;“߻ƼĮ\;}}{\;}$N2+2CO2£¬
¹Ź“š°øĪŖ£ŗ2NO+2CO$\frac{\underline{\;“߻ƼĮ\;}}{\;}$N2+2CO2£»
£Ø3£©Ī²ĘųÖŠ¶žŃõ»ÆµŖŗ¬ĮæĪŖ1”Į106L”Į0.5%=0.5”Į104L£¬ÉčŠčŅŖ°±Ęųxmol
6NO2 +8NH3 ØT7N2 +12H2O
6”Į22.4L 8mol
0.5”Į104 L x
½āµĆ£ŗx=297.62mol£®Ōņ°±ĘųµÄÖŹĮæĪŖ297.62”Į17”Į10-3kg=5.06 kg£¬
¹Ź“š°øĪŖ£ŗ5.06£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬ĪŖøßĘµæ¼µć£¬×¢Ņā“ÓŌŖĖŲ»ÆŗĻ¼ŪµÄ½Ē¶ČČĻŹ¶Ļą¹ŲøÅÄī£¬½įŗĻ·“Ó¦µÄ»Æѧ·½³ĢŹ½¼ĘĖć£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
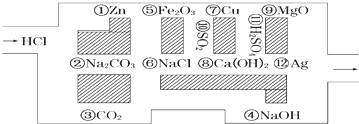
| A£® | ³£ĪĀ³£Ń¹ĻĀ£¬16gCH4ŗ¬ÓŠ10NAøöµē×Ó | |
| B£® | 0.1mol•L-1µÄŃĪĖįČÜŅŗÖŠŗ¬ÓŠ0.1NAøöH+ | |
| C£® | 1molNaÓėŅŅ“¼ĶźČ«·“Ó¦£¬Ź§Č„2NAøöµē×Ó | |
| D£® | ±ź×¼×“æöĻĀ£¬22.4L±½ŗ¬ÓŠNAøö±½·Ö×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
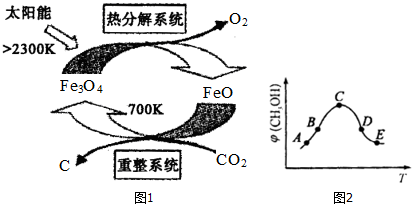
| ČŻĘ÷ | ¼× | ŅŅ |
| ·“Ó¦ĪļĶ¶ČėĮæ | 1molCO2”¢3molH2 | a molCO2”¢b molH2”¢c molCH3OH£Øg£©”¢c molH2O£Øg£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
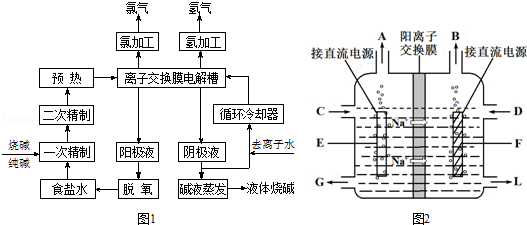
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆČÜŅŗ³ŹĒ³ĀĢÉ« | |
| B£® | øĆČÜŅŗÖŠ¼ÓČėNaOHČÜŅŗ£¬Éś³É°×É«³Įµķ²¢ŃøĖŁ±ä³É»ŅĀĢÉ«£¬×īŗó±äĪŖŗģŗÖÉ« | |
| C£® | ĻņøĆČÜŅŗÖŠ¼ÓČėĀČĖ®£¬ŌŁµĪČė¼øµĪKSCNČÜŅŗ£¬³ŹŗģÉ« | |
| D£® | ĻņøĆČÜŅŗÖŠµĪČė¼øµĪKSCNČÜŅŗ£¬²»±äÉ«£¬ŌŁ¼ÓČėĀČĖ®£¬³ŹŗģÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
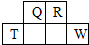 ¶ĢÖÜĘŚŌŖĖŲQ”¢R”¢T”¢WŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠTµÄµ„ÖŹ¼ČæÉÓėŃĪĖį·“Ó¦£¬ÓÖæÉÓėNaOHČÜŅŗ·“Ó¦£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¶ĢÖÜĘŚŌŖĖŲQ”¢R”¢T”¢WŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠTµÄµ„ÖŹ¼ČæÉÓėŃĪĖį·“Ó¦£¬ÓÖæÉÓėNaOHČÜŅŗ·“Ó¦£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ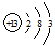 £®
£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com