
科目:高中化学 来源: 题型:解答题
 I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+ | B. | 还原性:Br->Cl- | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 酸性:H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
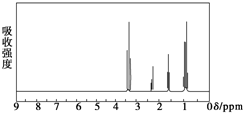 核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的核磁共振氢谱如图所示.则可能是下列物质中的( )
核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的核磁共振氢谱如图所示.则可能是下列物质中的( )| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | 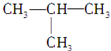 | D. | CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.3:1 | B. | 3.5:1 | C. | 3.7:1 | D. | 3.9:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
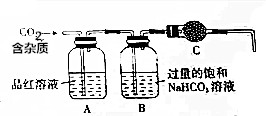 实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:
实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com