
【题目】乙烯产量是衡量一个国家石油化工水平的主耍标志。下图是由乙烯合成乙酸乙酯可能的合成路线:
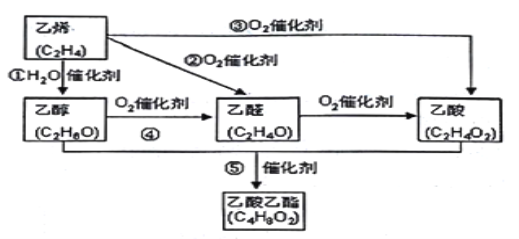
请回答下列问题:
(1)反应④的化学方程式为_______________________________________________________。
(2)在实验室制备乙酸乙酯时,用到饱和的碳酸钠溶液,其作用是_____________________。
(3)乙醇的结构式为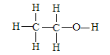 ,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为_______________________________________。
,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为_______________________________________。
【答案】2CH3CH2OH+O2![]() 2CH3CHO+2H2O吸收挥发出来的乙酸和乙醇;降低乙酸乙酯的溶解度2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
2CH3CHO+2H2O吸收挥发出来的乙酸和乙醇;降低乙酸乙酯的溶解度2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
【解析】
(1)反应④是乙醇的催化氧化生成乙醛,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(2)在实验室制备乙酸乙酯时生成的乙酸乙酯中含有乙酸和乙醇,因此用到饱和的碳酸钠溶液吸收乙酸乙酯,其作用是吸收挥发出来的乙酸和乙醇、降低乙酸乙酯的溶解度,便于乙酸乙酯分层析出。
(3)乙醇的结构式为 ,含有1个醇羟基,醇羟基能与活泼金属钠反应放出氢气,而另外5个氢原子与钠不能反应,则实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑。
,含有1个醇羟基,醇羟基能与活泼金属钠反应放出氢气,而另外5个氢原子与钠不能反应,则实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A.只含有一种元素的物质一定是纯净物
B.石墨在一定条件下转变为金刚石是化学变化
C.有单质参加的反应一定是氧化还原反应
D.碳元素只能形成金刚石和石墨两种同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮。后来科学家利用N2又制出N3、N4、N5、N60及含N5+的化合物等。下列说法正确的是( )
A.N3、N4、N5、N60都是氮的同位素
B.5N2=2N5是化学变化
C.高聚氮与N2、N3、N4、N5+、N60互为同素异形体
D.NO和NO2互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液,相应的实验过程可用下图表示。请回答:
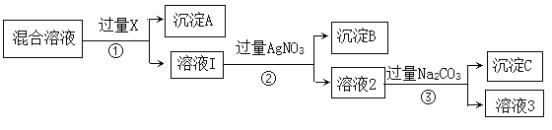
(1)沉淀A是__________(填化学式)。
(2)步骤③中加入过量Na2CO3的作用为________________________。
(3)若要获得纯净的NaNO3固体,需要向溶液3中加入过量的___________。反应的离子方程式为_______________________,反应后还需进行的实验操作为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
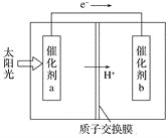
A. 该过程是将太阳能转化为化学能的过程
B. 催化剂a表面发生氧化反应
C. 催化剂a 附近酸性减弱
D. H+将在催化剂b的表面反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
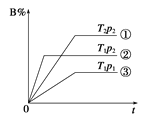
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 化学平衡常数的表达式K=![]()
B. 当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡状态
C. 若达到平衡状态时两种反应物的转化率相等,则起始投入时n(NH3)∶n(O2)=4∶5
D. 反应达到平衡状态后,改变条件平衡使平衡向正反应方向移动,c(H2O)一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为2 L的密闭容器中发生反应2X(g)+Y(g)![]() 2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
①升高温度,W的体积分数减小,ΔH增大 ②以Y的浓度变化表示的反应速率为0.01 mol·L-1·s-1 ③在其他条件不变的情况下,增加1 mol X,则X和Y的转化率均提高 ④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动 ⑤再向容器中通入2 mol X和1 mol Y,达到平衡时,X、Y的转化率均增大
A. ⑤ B. ①⑤ C. ②③④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下:①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1 ②N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )
2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )
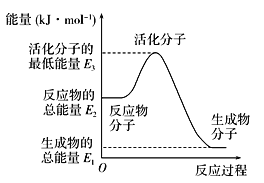
A. 反应②中的能量变化如上图所示,则ΔH=E1-E3
B. 2 mol H2(g)完全燃烧生成液态水时放出的热量小于483.6 kJ
C. 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D. 氨催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com