
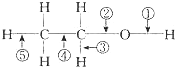
 在乙醇的化学性质中,各反应的断键方式可概括如下:
在乙醇的化学性质中,各反应的断键方式可概括如下:

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为
与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| ①分别取等体积的2mol.L-1 H2SO4 于试管中 ②分别投入大小、形状相同的 Cu、Fe、 Mg. |
镁反应速率比铁快, 铜不反应 |
(1) |
 (3)用此装置进行定量实验,应选用上述的实验药品是:
(3)用此装置进行定量实验,应选用上述的实验药品是:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾溶于水形成的Al(0H)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、用氧化铝坩埚加热熔化氢氧化钠固体 |
| C、二氧化硅可以用于制造光导纤维 |
| D、硅用作太阳能电池材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com