
 ,过氧化氢的电子式
,过氧化氢的电子式 .
.分析 (1)根据电子式的书写方法写出过氧化氢的电子式;
(2)根据热化学方程式的书写原则和注意问题写出;注意物质的聚集状态标注,焓变的正负号和单位;
(3)结合上述写出的热化学方程式和谁转化的热化学方程式,根据盖斯定律合并写出生成液态水时的热化学方程式进行计算.
解答 解:(1)过氧化氢的电子式为 ,结构式中共用电子对用短线表示,所以结构式为
,结构式中共用电子对用短线表示,所以结构式为 ,
,
故答案为: ;
; ;
;
(2)已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量,1mol液态肼和足量双氧水反应生成氮气和水蒸气时放出641.63KJ的热量;肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;
(3)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;
②H2O(g)=H2O(l)△H=-44KJ/mol;
依据盖斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.63KJ/mol;
化学方程式中32g全部反应放热817.63KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408.815KJ,
故答案为:408.815.
点评 本题考查了热化学方程式的书写方法和注意问题,盖斯定律的应用,热化学方程式的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应2~4分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
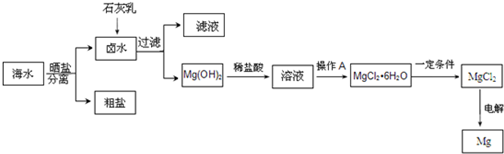
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2、C2H6 | B. | H2O、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、SiC、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①、②、③加成反应 | |
| B. | 溴水中加入苯,二者可发生取代反应 | |
| C. | 乙苯中所有碳原子一定在同一平面上 | |
| D. | 能用溴水判断反应②所得的乙苯中是否混有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤干馏可以提高能源的利用率 | |
| B. | 甲烷也是一种温室气体,应禁止使用天然气 | |
| C. | 锌-锰干电池是对环境没任何污染的理想电池 | |
| D. | 寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
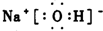 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 充电电池可以无限制地反复使用 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 废旧电池不能乱扔,需回收处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧族元素包括氧、硫、锡、碲、钋 | |
| B. | Na2O2固体中的阳离子和阴离子个数比为1:1 | |
| C. | H、D、T、H+可以用来表示氢元素的四种同位素 | |
| D. | 表示金属元素名称的汉字不一定都含“钅”旁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com