
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
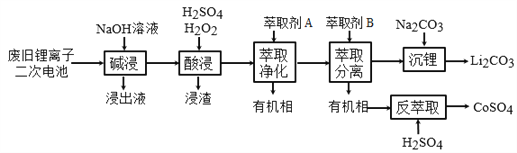
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
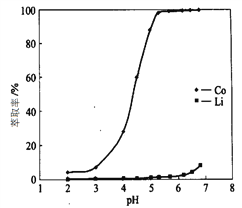
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
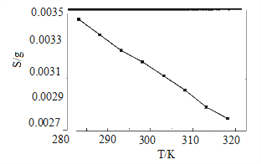
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
【答案】 除去铝 2 LiCoO2 + H2O2 + 6H+=2Li++2Co2+ + O2↑ + 4 H2O 石墨、硫酸钙 Fe3+ 分离效率最高 Li2CO3溶解过程为放热反应 洗涤 88.0%
【解析】分析:本题是化学流程图问题,主要是判断清楚每步反应的投料和产出,各个步骤的流程,最后分析清楚杂质是如何除去的。
详解:(1)“碱浸”的目的是用氢氧化钠溶液将其中的Al溶解。
(2)LiCoO2中Co为+3价,最后生成的CoSO4中Co为+2价,所以酸浸这一步中,加入H2O2的目的是为了将+3价Co还原为+2价Co,所以反应的而梨子反应方程式为:2 LiCoO2 + H2O2 + 6H+=2Li++2Co2+ + O2↑ + 4 H2O。浸渣中主要是不与酸反应的石墨以及生成的硫酸钙沉淀。
(3)整个提取的过程中需要除去的杂质是Ca、Fe、Al、Ni;在前面的步骤中已经除去了Al和Ca,所以萃取净化应该要除去Ni2+和Fe3+。
(4)由图示在pH为5左右的时候,Co和Li的萃取率差异最大,此时分离的效果最好。
(5)①图中显示随着温度升高,碳酸锂的溶解度逐渐减小,所以褪色该物质溶于水的过程是放热的。
②提取的过程为热过滤,洗涤,干燥,所以答案为:洗涤。
③c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,则碳酸钠的浓度也是1.0 mol·L1,加入的瞬间溶液体积转化为原来的2倍,浓度都是原来的一半,即c(Li+)= c(CO32-)=0.5 mol·L1,沉淀出碳酸锂,所以碳酸根过量1倍,剩余c(CO32-)=0.25 mol·L1,带入KSP的计算式得到c(Li+)= ![]() mol/L。因为两溶液混合的瞬间c(Li+)=0.5mol/L,所以沉锂率为(0.5-0.06)÷0.5=88%。
mol/L。因为两溶液混合的瞬间c(Li+)=0.5mol/L,所以沉锂率为(0.5-0.06)÷0.5=88%。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室的硫酸试剂标签上的部分内容。据此,下列说法正确的是
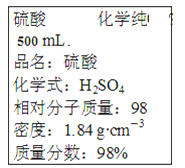
A. 该硫酸的物质的量浓度为9.2mol·L-1
B. 1mol Fe与足量的稀硫酸反应,标准状况下产生44.8L气体
C. 若实验室需要4.6 mol/L的稀硫酸500mL,配制稀硫酸时则应量取该硫酸125.0mL
D. 该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
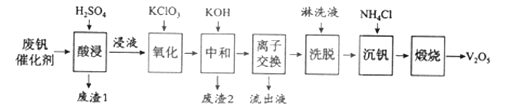
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________
(2)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________,___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作不能达到相应目的的是( )
|
|
|
|
A.干燥Cl2 | B.分离汽油与食盐溶液 | C.实验室制取少量蒸馏水 | D.比较Na2CO3与NaHCO3的稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是

A. O2所在的铂电极处发生氧化反应
B. H+透过质子交换膜流向呼气所在的铂电极
C. 电路中流过2mol电子时,消耗标准状况下11.2LO2
D. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列说法正确的是
A. 按系统命名法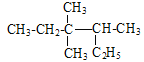 的名称为3,3-二甲基-2-乙基戊烷
的名称为3,3-二甲基-2-乙基戊烷
B. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
C. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
D. 聚乙烯( PE)和聚氯乙烯( PVC)的单体都是不饱和烃,这些单体均能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下,反应 X(g)+3Y(g![]() 2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是
2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是

A. 图中a、b两点对应的平衡常数相等
B. 上述反应在达到平衡后,缩小体积,Y的转化率提高
C. 升高温度,正、逆反应速率增大,平衡向正反应方向移动
D. 将2.0molX、6.0molY,置于密闭容器中发生反应,放出的热量为2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于3Br2+6NaOH![]() 5NaBr+NaBrO3+3H2O的反应,下列说法中不正确的是( )
5NaBr+NaBrO3+3H2O的反应,下列说法中不正确的是( )
A. Br 2既是氧化剂,又是还原剂
B. 被氧化的溴原子与被还原的溴原子质量比是1:5
C. NaBr是氧化产物,NaBrO3是还原产物
D. 转移1mol电子时,消耗NaOH 1.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com