
 .
. .
.分析 B是短周期中金属性最强的元素,则B为Na;而B、C、D、E、F是原子序数依次增大的短周期主族元素,元素均处于第三周期,C是同周期中离子半径最小的元素,则C为Al;D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则D为Si,M为Na2SiO3,E的最外层电子数与内层电子数之比为3﹕5,则最外层电子数为6,故E为S元素,则F为Cl元素,据此解答.
解答 解:B是短周期中金属性最强的元素,则B为Na;而B、C、D、E、F是原子序数依次增大的短周期主族元素,元素均处于第三周期,C是同周期中离子半径最小的元素,则C为Al;D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则D为Si,M为Na2SiO3,E的最外层电子数与内层电子数之比为3﹕5,则最外层电子数为6,故E为S元素,则F为Cl元素.
(1)D为Si元素,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)工业制氯气的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)元素B与元素F形成的化合物为NaCl,其电子式为: ,故答案为:
,故答案为: ;
;
(4)Na与氧气反应的产物与Al单质同时放入水中,产生两种无色气体,应是过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠与Al反应生成偏铝酸钠与氢气,有关的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(5)Na2SiO3与盐酸反应的离子方程式:SiO3 2-+2H+=H2SiO3↓,
故答案为:SiO32-+2H+=H2SiO3↓;
(6)工化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl,
故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,考查学生运用知识分析问题、解决问题的能力,难度中等.


科目:高中化学 来源: 题型:解答题
| A | 最外层电子数是电子层数的2倍,单质为黑色固体 |
| B | 单质是空气的主要成分之一 |
| C | 与B不同主族,单质为淡黄色固体,易溶于二硫化碳 |
| D | 一种非金属元素 |
| E | 与D形成的某种化合物的水溶液遇苯酚溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
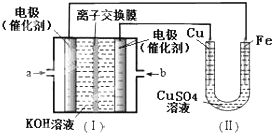
| A. | a处通入O2 | B. | b处发生氧化反应 | ||
| C. | 电流由Cu电极移向b | D. | Fe电极发生的反应为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
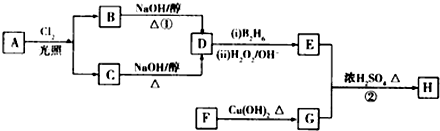
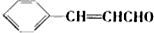 回答下列问题:
回答下列问题: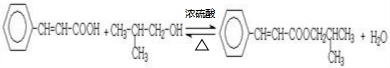 .
.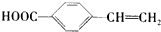 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 血糖过低的患者可利用静脉注射葡萄糖溶液的方法迅速补充营养 | |
| B. | 装运乙醇的包装箱应贴的图标是 | |
| C. | 用活性炭为糖浆脱色和用SO2漂白纸浆的原理不同 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒不同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


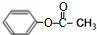 .
.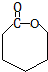 .
.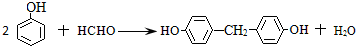 .
. .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com