
分析 (1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化;
(2)①在加热条件下,浓硫酸与Fe反应生成Fe3+,当溶液浓度减小时,硫酸氧化性减弱,生成Fe2+;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;
(3)Al和水不反应,所以剩余金属应该是Al,根据Na和Al之间的关系式及转移电子守恒计算;
(4)n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol<0.3mol,所以有两种情况:一种是铝元素存在于偏铝酸钠和氢氧化铝中,一种情况是铝元素存在于氯化铝和氢氧化铝中,根据物质之间的关系式计算;
(5)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,根据硫酸根离子守恒计算硫酸亚铁的物质的量浓度.
解答 解:(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,
故答案为:铁表面被钝化;
(2)①在加热条件下,浓硫酸与Fe反应生成Fe3+,当溶液浓度减小时,硫酸氧化性减弱,生成Fe2+,反应的离子方程式为Fe+2H+=Fe2++H2↑,如硫酸完全消耗,且铁过量时,还会发生Fe+2Fe3+=3Fe2+,
故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合气体)=$\frac{0.336L}{22.4L/mol}$=0.015mol,
SO2→BaSO4
1mol 233g
n 2.33g
n=0.01mol
则 SO2的体积分数:$\frac{0.01mol}{0.015mol}$=66.7%,
故答案为:SO2+Br2+2H2O=2HBr+H2SO4;66.7%;
(3)Al和水不反应,所以剩余金属应该是Al,反应方程式为2Na+2H2O=2NaOH+H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可以得出关系式Na~NaOH~Al,则参与反应的Na和Al的质量之比为23:27,Na和Al的质量和为15g,所以n(Na)=$\frac{\frac{15g}{23+27}×23}{23g/mol}$=0.3mol,n(Al)=$\frac{\frac{15g}{23+27}×27}{27g/mol}$=0.3mol,根据Na、Al和氢气之间的关系式得氢气体积=(0.3mol×0.5+0.3mol×1.5)×22.4L/mol=13.44L,
故答案为:13.44;
(4)n(Al(OH)3)=$\frac{7.8g}{78g/mol}$=0.1mol<0.3mol,一种情况是:铝元素存在于偏铝酸钠和氢氧化铝中,此时盐酸少量,只能沉淀一部分AlO2-,根据NaAlO2+HCl+H2O=Al(OH)3↓+NaCl得,n(HCl)=n(Al(OH)3)=0.1mol,则盐酸体积=$\frac{0.1mol}{1mol/L}$=100mL;
另一种情况是铝元素存在于氯化铝和氢氧化铝中,此时盐酸较多,先把AlO2-全部沉淀,后又将部分沉淀溶解,生成氢氧化铝需要n(HCl)=n(NaAlO2)=n(Al(OH)3)=0.3mol,溶解Al(OH)3生成氯化铝需要盐酸的n(HCl)=3n(AlCl3)=3×(0.3-0.1)mol=0.6mol,所以需要盐酸体积=$\frac{0.3mol+0.6mol}{1mol/L}$=900mL,
故答案为:100或900;
(5)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,n(H2SO4)=2.2mol/L×0.12L=0.264mol,
与氢氧化钠反应的硫酸的物质的量=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×2mol/L×0.04L=0.04mol,
剩余的硫酸的物质的量=0.264mol-0.04mol=0.224mol,
剩余硫酸与固体反应生成了硫酸亚铁,根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度为:$\frac{0.224mol}{0.12L}$=1.87mol/L,
故答案为:1.87.
点评 本题考查了有关混合物的计算,难度不大,明确各物理量之间的关系是解本题的关键,注意该题中气体的体积和固体的质量对该题的干扰,否则会导致解题错误,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 0~5min,SO2的生成速率v(SO2)=0.12mol•L-1•min-1 | |
| B. | 若起始时充入3 mol SO3,起始时SO3分解速率不变 | |
| C. | 若某时刻消耗了1 molSO3同时生成了0.5molO2,则表明该反应达到了平衡状态 | |
| D. | 达到平衡时,SO2和SO3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
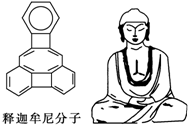 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子(如图所示),就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子(如图所示),就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )| A. | 该有机物属于苯的同系物 | B. | 该有机物属于芳香烃 | ||
| C. | 该有机物分子中含有22个碳原子 | D. | 该有机物一氯代物只有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用长颈漏斗分离出乙酸与乙醇反应的产物 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| D. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖银镜反应实验后的试管内壁附有银,可用氨水清洗 | |
| B. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| C. | 用标准酸溶液滴定未知碱溶液时,盛装待测溶液的锥形瓶不需要用待测溶液润洗 | |
| D. | 测定溶液pH的操作:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在试纸中部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或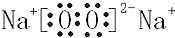 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与盐酸反应:O2-+2H+=H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3+2HClO | |
| C. | 大理石跟盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 醋酸和氨水反应:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
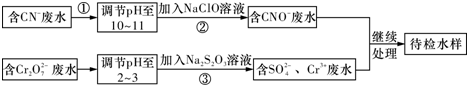
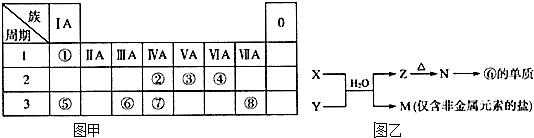
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com