
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
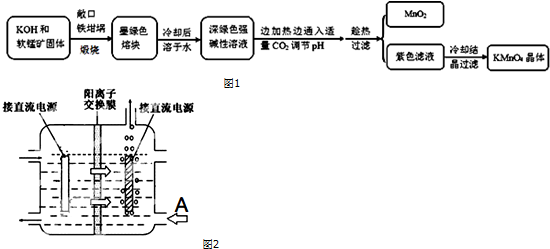
分析 以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体,软锰矿固体和KOH固体混合在铁坩埚中煅烧,得到墨绿色熔块,为锰酸钾,冷却后溶于水其水溶液呈深绿色,这是锰酸根(MnO42-)在碱溶液中的特征颜色,边加热边通入适量二氧化碳气体,调节溶液PH趁热过滤得到二氧化锰固体和高锰酸钾溶液,冷却结晶得到高锰酸钾晶体.
(1)二氧化硅和强碱反应,坩埚被腐蚀;
(2)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4;氧化还原反应中氧化剂是元素化合价降低的物质,还原剂是元素化合价升高的物质,结合化学方程式定量关系和电子守恒计算;
(3)结合溶解度以及物质的性质判断;
(4)惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中氢离子在阴极得到电子生成氢气,溶液中氢氧根离子浓度增大生成碱,阳离子交换膜分隔两极区进行电解锰酸钾溶液制取高锰酸钾,阳离子移向方向可知左边电极为阳极,右边冒气泡的电极为阴极,为维持电解质溶液电荷守恒,A处最好加入氢氧化钾溶液,使用阳离子交换膜可以提高Mn元素利用率是因为阳离子交换膜防止锰酸根进入阴极区.
解答 解:(1)石英坩埚中的二氧化硅和强碱反应,坩埚被腐蚀,加热软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚,
故答案为:强碱腐蚀石英;
(2)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,实验中通入适量CO2时体系中可能发生反应离子方程式为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O,其中氧化还原反应中氧化剂和还原剂都是高锰酸钾,所以氧化剂和还原剂的质量比即为反应的物质的量之比为1:2;
故答案为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;1:2;
(3)因为盐酸具有还原性,易被高锰酸钾氧化,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时基本上都会留在母液中,硫酸加入生成的硫酸钾溶解度小,会随KMnO4一起结晶析出得到的高锰酸钾中含有杂质;
故答案为:A;
(4)惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中氢离子在阴极得到电子生成氢气,溶液中氢氧根离子浓度增大生成碱,电解反应的化学方程式为:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH,阳离子交换膜分隔两极区进行电解锰酸钾溶液制取高锰酸钾,阳离子移向方向可知左边电极为阳极,右边冒气泡的电极为阴极,为维持电解质溶液电荷守恒,A处最好加入氢氧化钾溶液,使用阳离子交换膜可以提高Mn元素利用率是因为阳离子交换膜防止锰酸根进入阴极区被还原;
故答案为:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
点评 本题考查物质的制备实验,为高考常见题型,题目涉及常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| A. | ⅠA | B. | ⅡA | C. | ⅢA | D. | ⅣA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 同温同压下,H2(g)+Cl2=2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 反应A(g)?2B(g),若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则该反应的△H=(Ea-Eb) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5 kJ•mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热△H=-571.6 kJ•mol-1 | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)═2H2O2(l)△H1=+108.3 kJ•mol-1 ① N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2=-534.0 kJ•mol-1 ② 则有反应:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-642.3 kJ•mol-1 | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g) 放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g) 放出能量 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com