
电极及电极判断.
①负极:电子________的一极,电流________的一极,电解质溶液内,________移向的极,通常是活泼性较________的金属,电极被________,发生________反应.如:Zn-2e-![]() Zn2+.
Zn2+.
②正极:电子________的一极,电流________的一极,电解质溶液内,________移向的极,通常是活泼性较________的金属或非金属导体,电极上发生________反应.如:2H++2e-![]() H2↑.
H2↑.
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:阅读理解
 (2010?江苏二模)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
(2010?江苏二模)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.| 25 |
| 2 |
| 25 |
| 2 |
| 放电 |
| 充电 |
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c (02)/mol?L-1 | c (C02)/mol?L-1 | v(正)和v (逆)比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
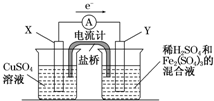 (2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)2- 4 |
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | 负 负 |
铜 铜 |
Cu-2e-═Cu2+ Cu-2e-═Cu2+ |
| Y极 | 正 正 |
碳 碳 |
2Fe3++2e-═2Fe2+ 2Fe3++2e-═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| O | 2- 7 |
| O | 2- 4 |
| O | 2- 7 |

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省姜堰市高三上学期学情调查(三)化学试卷 题型:填空题
因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,

其总反应式是:

根据所给信息判断,混合动力车下坡或刹车时,甲电极的电极反应式为_______;混合动力车上坡或加速时,乙电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
CO(g)+1/2O2(g) CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
|
容器编号 |
c(CO)/mo1·L-1 |
c (O2)/mol·L-1 |
c (CO2)/mol·L-1 |
v(正)和v (逆)比较 |
|
I |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)=v(逆) |
|
Ⅱ |
3.0×10-4 |
4.0×10-4 |
8.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-l和1.0×10-4mol·L-l。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中CO的浓度为_________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com