
【题目】下列物质的水溶液不能导电的是( )
A.KOHB.NaHCO3C.HClD.CH3CH2OH
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
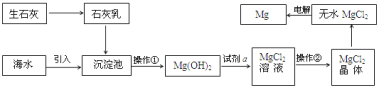
提示: ①MgCl2晶体的化学式为MgCl26H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 ________, 操作②的名称___________、冷却结晶、过滤。
(2)试剂a的名称是_____________。
(3)用氯化镁电解生产金属镁的化学方程式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3:
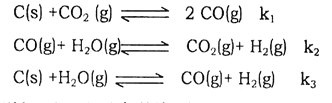
则K1、K2、K3之间的关系是K3=__________________
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A. Y的最简单氢化物的热稳定性比Z的强
B. 在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C. 离子半径:X<Y<Z<W
D. 含W的盐溶液可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成以下问题:
(1)下列反应中,属于吸热反应的是______________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③酸碱中和反应
④铝粉与氧化铁粉末在高温下反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为____(“吸热”或“放热”)反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
(3)相对分子质量为72的烷烃的分子式为______________。
(4)有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如图
。玫瑰的香味物质中包含苧烯,苧烯的键线式如图![]() ,苧烯的分子式为___________。
,苧烯的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你回答下列问题:
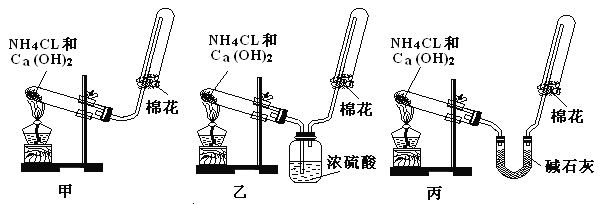
(1)三位同学制取氨气的化学方程式为:___________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_____________________。
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是_______ 填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)__________________。
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是_______ (填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?_______ (填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温、体积为1.0L的密闭容器中通入1.0molN2和xmolH2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20min内,V(N2)=______。
(2)该反应的热化学方程式为____________。
(3)下列叙述中能表示该反应达到平衡状态的是_______(填序号)。
①N2体积分数保持不变
②单位时间断裂03tmolH-H键,同时生成0.6molN-H键
③混合气体的密度不再改变
④2v正(H2)=3v逆(NH3)
⑤混合气体的平均摩尔质量不再改变
II.1883年,瑞典化学家阿伦尼乌斯创立了电离学说,在水溶液范围内对酸、碱作出了严密的概括。请回答下列有关水溶液的问题:
(4)①用电离方程式表示氨水溶液是碱性的原因________;
②用离子方程式表示碳酸钠溶液显碱性的原因__________。
(5)25℃时,在含HA和A-的溶液中,HA和A-两者中各自所占的物质的量分数(a)随溶液pH变化的关系如下图所示。请比较下列大小关系(填编号)
①在pH<4.76的溶液中,c(A-)____(HA);
②在pH>4.76的溶波中,c(A-)+(OH-)_____c(H+)。
A.大于 B.小于 C.等于 D.可能大于,也可能等于 E.可能小于,也可能等于

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com