
| A.N2 | B.N2O | C.NO | D.NO2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
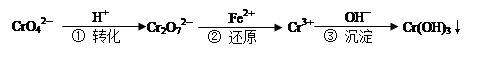
| A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化 |
| B.若2v (Cr2O72—) ="v" (CrO42—),说明反应①达平衡状态 |
| C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+ |
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+ Fe(OH) 2↓+ 2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在此反应中硝酸体现强氧化性,全部被还原 |
| B.向反应后的溶液中再加入金属铁,不再发生化学反应 |
| C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4 |
| D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该合金中铜与镁的物质的量之比是46:69 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.产生沉淀8.51 g |
| D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2| A.反应①和②均为氧化还原反应 |
| B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.Na2Cr2O7中Cr元素的化合价为+7 |
| D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.24 mol | B.0.16 mol | C.0.21 mol | D.0.14 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
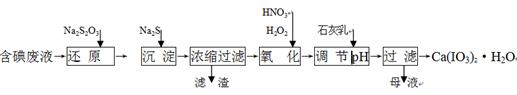
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com