
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
分析 (1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g),随反应进行温度升高,平衡逆向进行,
①单位时间内生成2n mol NH3的同时生成3n mol H2 ,此时正逆反应速率相同;
②单位时间内生成6n mol N-H键,是指生成2molNH3,同时生成2n mol H-H键,说明是生成2molH2,氢气生成少于氨气生成;
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比始终为1:3:2;
④反应前后气体质量不变,正反应气体物质的量减小,混合气体的平均摩尔质量增大;
⑤气体质量和体积不变,容器内的气体密度始终不变;
(2)①依据反应的焓变结合化学方程式计算放出的热量;
②根据3、4小时的时间段氨气的物质的量不变,说明达到了平衡状态,根据氨气的物质的量计算出消耗的氮气和氢气的物质的量及平衡时的浓度,
再根据平衡常数表达式K=$\frac{{C}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$计算出该温度下的平衡常数;
③根据加入氨气、水和氨气后的浓度商判断平衡移动方向;
④由于1molN2和6molH2完全反应可以生成2molNH3,在相同条件下向乙容器中加入2mol NH3 (g)和3mol H2 (g),极值转化为起始量,相当于起始量为1molN2和6molH2,所以甲乙两个体系的平衡状态是一样的,即对应气体的浓度完全相同. 对于同一可逆反应,相同条件下,正反应的反应热与逆反应的反应热,数值相等,符号相反,N2和H2完全反应时放热Q,则NH3完全分解时吸热也是Q,根据三段式利用x表示出平衡时甲容器内反应混合物各组分的物质的量为 N2(1-x )mol、H2(6-3x )mol、NH32xmol,放出热量Q1=xQkJ;则乙容器反应混合物各组分的物质的量也是为 N2(1-x )mol、H2(6-3x )mol、NH32xmol,所以分解的NH3的物质的量为(2-2x)mol,吸收热量(1-x)QkJ,利用Q2=4Q1,列放出求出x的值,转化的H2为3x,利用转化率定义计算;
解答 解:(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g),随反应进行温度升高,平衡逆向进行,
①单位时间内生成2n mol NH3的同时生成3n mol H2 ,此时正逆反应速率相同,反应达到平衡状态,故①不符合;
②单位时间内生成6n mol N-H键的同时生成2n mol H-H键,氢气生成少于氨气生成,平衡正向进行,故②符合;
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比始终为1:3:2,不能说明反应正向进行,故③不符合;
④反应前后气体质量不变,气体物质的量减小,当混合气体的平均摩尔质量增大,说明反应正向进行,故④符合;
⑤气体质量和体积不变,容器内的气体密度始终不变,不能说明反应正向进行,故⑤不符合;
故答案为:②④;
(2)①N2(g)+3H2(g)?2NH3(g)△H=-92.60kJ•mol-1,生成2mol氨气放热92.60kJ,反应进行到2小时时,氮气的物质的量变化了1.5mol-1.2mol=0.3mol,则生成氨气0.6mol,放出的热量为$\frac{92.6}{2}$kJ×0.6=27.78kJ,
故答案为:27.78;
②根据表中数据可知,反应在第3和4小时时间段内氨气的物质的量不变,说明达到了平衡状态,此时生成了1.00mol氨气,
列出化学平衡的三段式为 N2(g)+3H2(g)?2NH3(g),
反应开始前(mol) 1.5 4.5 0
变化量(mol) 0.5 1.5 1
平衡时(mol) 1 3 1
平衡时浓度(mol/L) 0.500 1.500 0.5
此温度下该反应的化学平衡常数K=$\frac{{C}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$=$\frac{0.{5}^{2}}{1.{5}^{3}×0.5}$≈0.15,
故答案为:0.15;
③反应达到平衡后,若往平衡体系中再加入N2、H2O、NH3各1mol,此时各组分的浓度为:
c(N2)=$\frac{1.00mol+1.00mol}{2.00L}$=1.00mol/L,c(H2)=$\frac{3.00mol+1.00mol}{2.00L}$=2.00mol/L,c(N2)=$\frac{1.00mol+1.00mol}{2.00L}$=1.00mol/L,
浓度商为:Qc=$\frac{{C}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$
=$\frac{1.0{0}^{2}}{2.0{0}^{3}×1.00}$=0.125<k=0.15,所以平衡向着正向移动,
故答案为:正反应.
由于1molN2和3molH2完全反应可以生成2molNH3,所以甲乙两个体系的平衡状态是一样的,即三种气体的浓度完全相同,对于同一可逆反应,相同条件下,正反应的反应热与逆反应的反应热,数值相等,符号相反.N2和H2完全反应时放热Q,则NH3完全分解时吸热也是Q,
④假设甲容器中的参加反应的氮气的物质的量为xmol,所以:
对于甲容器:N2(g)+3H2(g)?2NH3(g)△H=-QkJ/mol
起始(mol):1 6 0
变化(mol):x 3x 2x
平衡(mol):1-x 6-3x 2x
所以Q1=xQkJ,
乙容器反应混合物各组分的物质的量也是为N2(1-x )mol、H2(6-3x )mol、NH32xmol,所以分解的NH3的物质的量为(2-2x)mol,
对于乙容器:2NH3(g)?N2(g)+3H2(g)△H=+QkJ/mol,故吸收的热量Q2=$\frac{2-2x}{2}$QkJ=(1-x)QkJ,所以(1-x)Q=4xQ,解得x=0.2,所以H2的转化率为$\frac{0.2mol×3}{6mol}$×100%=10%,故答案为:10%;
点评 本题考查了盖斯定律的应用、反应热的计算、化学平衡常数的计算与应用、化学反应速率与化学计量数的关系等知识,涉及的知识点较多,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Na+ | C. | CO32- | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠固体因易接触到空气中H2O和CO2而变质,所以要密封保存 | |
| B. | 少量金属钠保存在煤油中,大量金属钠用石蜡密封保存 | |
| C. | 硝酸银、新制的饱和氯水保存在棕色细口瓶,并放在阴凉处 | |
| D. | 84消毒液一般可敞口在空气中长久存放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
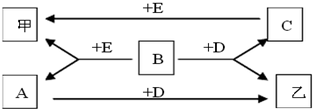 已知甲、乙两种白色固体都不溶于水不溶于稀硝酸,A、B、C、D、E 均是能溶于水的化合物.
已知甲、乙两种白色固体都不溶于水不溶于稀硝酸,A、B、C、D、E 均是能溶于水的化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com