
【题目】电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。含CN-废水在排放前的处理过程如下:

已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标准状况下密度为1.25g/L的单质气体1.12L。
(1)溶液B具有性质_______________(填“氧化性”或“还原性”)。
(2)写出沉淀D在氧气中灼烧发生的化学方程式___________________________________。
(3)滤液C中还含有微量的CN-离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理_________________________________。
【答案】 还原性 2CuCN+3O2 ![]() 2CuO+N2+2CO2 2CN +5ClO+2H+=5Cl+N2↑+2CO2↑+H2O
2CuO+N2+2CO2 2CN +5ClO+2H+=5Cl+N2↑+2CO2↑+H2O
【解析】9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,黑色固体应为CuO,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L,气体的相对分子质量为1.25×22.4=28,电镀溶液中含有高浓度的CN-离子,应为氮气,则白色沉淀为CaCO3,其物质的量为![]() =0.1mol,生成的二氧化碳为0.1mol,则碳元素质量为0.1mol×12g/mol=1.2g,氮气的质量为1.25g×1.12L=1.4g,物质的量为
=0.1mol,生成的二氧化碳为0.1mol,则碳元素质量为0.1mol×12g/mol=1.2g,氮气的质量为1.25g×1.12L=1.4g,物质的量为![]() =0.05mol,CuO的物质的量为
=0.05mol,CuO的物质的量为![]() =0.1mol,C、N、Cu元素总质量为1.2g+1.4g+0.1mol×64g/mol=9g,等于沉淀D的质量,故D由Cu、C、N三种元素组成,且三原子物质的量之比为0.1mol:0.1mol:0.05mol×2=1:1:1,故D的化学式为CuCN,X为Cu+离子,B应为具有还原性的物质;
=0.1mol,C、N、Cu元素总质量为1.2g+1.4g+0.1mol×64g/mol=9g,等于沉淀D的质量,故D由Cu、C、N三种元素组成,且三原子物质的量之比为0.1mol:0.1mol:0.05mol×2=1:1:1,故D的化学式为CuCN,X为Cu+离子,B应为具有还原性的物质;
(1)溶液B应具有还原性;
(2)沉淀D在氧气中灼烧发生的化学方程式:2CuCN+3O2![]() 2CuO+N2+2CO2;
2CuO+N2+2CO2;
(3)CN-离子与NaClO在酸性条件转化为对环境无害的物质,应是生成氮气、二氧化碳,还有氯化钠与水生成,反应离子方程式为:2CN-+5ClO-+2H+=5Cl-+N2↑+2CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究②④
①实验Ⅰ中生成红色物质的离子方程式为:____________________________
经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:_____________________
③请写出60s后反应进一步加快可能的原因(写出两条)_____________________________
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
假设二:________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
_____________________________________
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________________
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:______________________________________
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有V、W、X、Y、Z五种元素,它们的原子序数依次增大,且都小于20;其中X和Z是金属元素。已知V和Z属同一族,它们原子最外电子层上只有1个电子,W和Y也属同一族,W原子最外电子层上电子数是次外电子层上电子数的3倍,X原子最外电子层上电子数等于Y原子最外电子层上电子数的一半。请用相关的元素符号回答:
(1)X、Z各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为_____________;
(2)X最高价氧化物对应的水化物在水中电离方程式为:____________________________________;
(3)W与Z 可形成化合物Z2W2,该化合物的电子式为 ______________________________________;
(4)Y与Z形成的化合物水溶液pH ______ 7(填“>”、“<”或“=”),用离子方程式表示其原因 ____________________________________________________________;
(5)标准状况下,Y的最高价氧化物为无色晶体,该条件下0.20 mol该物质与一定量液态水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:________________________________;
(6)W与V 可形成化合物V2W2,该化合物的结构式为 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应![]()
![]()
![]() 在不同条件下进行时
在不同条件下进行时![]() 的转化率:
的转化率:
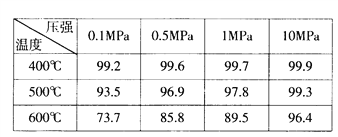
从上表中你得到的启示?
(1)关于可逆反应的限度:______________。
(2)提高该化学反应限度的途径有:________________。
(3)要实现![]() 的转化率为93.5%需控制的反应条件是___________________。
的转化率为93.5%需控制的反应条件是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在无色、强酸性溶液中能大量共存的是( )
A.Mg2+、K+、SO42﹣、CO32﹣
B.Na+、NO3﹣、Ac﹣、K+
C.Al3+、Na+、Cl﹣、SO42﹣
D.Na+、K+、MnO4﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机化合物A只由碳、氢两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工的发展水平。A、B、C、D、E有如下关系:
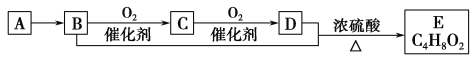
则下列推断不正确的是( )
A.鉴别A和甲烷可选用酸性高锰酸钾溶液
B.D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢
C.物质C的结构简式为CH3CHO,E的名称为乙酸乙酯
D.B+D→E的化学方程式为CH3CH2OH+CH3COOHCH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm);F原子中无中子,G在地壳中含量居第二位,H元素焰色反应呈紫色。根据题意请回答下列问题:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
(1)B的原子结构示意图为___________。
(2)F2C和F2E两种化合物中,沸点较高的是____(填化学式)。
(3)用电子式表示化合物H2E的形成过程_______________________________。
(4)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质为KOH。 则该电池的负极的电极反应式为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com