
科目:高中化学 来源: 题型:
下列反应所得溶液中一定只含一种溶质的是
A.向NaOH溶液中通入CO2 B.向Ca(OH)2溶液中通入Cl2
C.向蒸馏水中加入少量金属Na D.向MgSO4溶液中滴入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
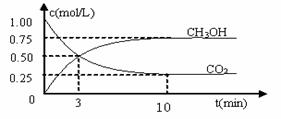
①反应开始到平衡,H2的平均反应速率v(H2)=_________________mol/(L·min),
②H2的转化率为 ______ ______ 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A、升高温度 B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离 D、再充入1mol CO2和3mol H2
E、使用催化剂 F、缩小容器体积
(2)①反应进行到3 min时,同种物质的v正 与v逆的关系: v正 v逆 (填>,=,<)
②上述反应平衡常数的表达式为 ,
经计算该温度下此反应平衡常数的数值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子,得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、e、d、c B.e、b、a、d、c
C.c、d、e、a、b D.b、a、d、c、e
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施能减慢化学反应速率的是
A.将煤块粉碎后燃烧
B.将食物贮藏在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.钠和水的反应:Na + H2O = Na+ + OH- + H2↑
B.氯化铝溶液中加入过量氨水:Al3+ + 3NH3?H2O = Al(OH)3↓+ 3NH4+
C.铁粉加入稀硫酸中:2Fe + 6H+ = 2Fe3+ + 3H2↑
D.氢氧化钡溶液跟稀硫酸反应:Ba2+ + OH- + H++ SO42- = BaSO4↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有的溶质是FeBr2、Fel2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br一一定被氧化
②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化
③不能确定通入氯气后的溶液中是否存在Fe2+
④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgN03溶液,只产生白色沉淀,说明原溶液中的I一、Fe2+、Br一均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容.
(1)请写出实验室制取NH3的化学方程式 Ca(OH)2+2NH4Cl  CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因 氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出.同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出.
多余 (用离子方程式和简要的文字说明)
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的  ,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理.设计成NH3﹣O2燃料电池,碱性条件下该电池负极电极反应为: 2NH3+6OH﹣﹣6e﹣=N2+6H2O .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com