
| A. | 用酸性KMn04溶液鉴别乙烯和乙炔 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 苯和硝基苯采用分液的方法分离 | |
| D. | 分离沸点相差30℃以上的混溶液体,采用蒸馏的方法 |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 常温下,测得饱和Na2CO3溶液的pH大于饱和 NaHCO3溶液的pH | 比较常温下水解程度: CO32->HCO3- |
| B | 向2mL甲苯中加入3滴KMnO4酸性溶液,振荡; 向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶 液,前者为黄色,后者为红褐色 | 证明温度升高,Fe3+的水解程度 增大 |
| D | 向盛有10滴0.1mol/LAgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol/L Na2S溶液 | 证明AgCl沉淀能转化为溶解度更小 的Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
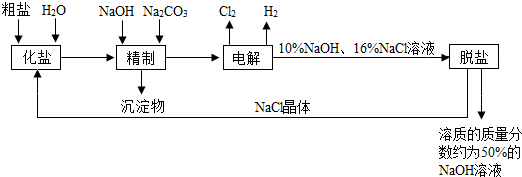
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铜比纳米铁金属活动性更强 | |
| B. | 纳米铜在反应中可能作氧化剂 | |
| C. | 纳米TiO2在不同溶剂中均形成了胶体 | |
| D. | 纳米TiO2有很强的氯化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液 | B. | KSCN溶液 | C. | NaOH溶液 | D. | NH3•H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液A的体积(mL) | KMnO4标准溶液的体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCN)>c(CN-) | B. | c(Na+)<c(CN-) | ||
| C. | c(HCN)-c(CN-)=c(OH-) | D. | c(HCN)+c(CN-)=2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | HOOC-COOH | C. | HO(CH2)2CHO | D. | HO- -COOH -COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com