
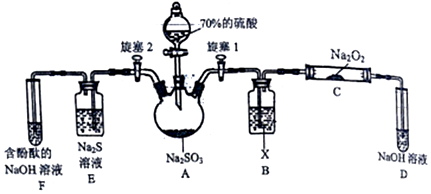
分析 I、A中制备二氧化硫,Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑,二氧化硫为酸性气体,X干燥二氧化硫,选用浓硫酸,C中SO2与Na2O2反应,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气,E装置验证二氧化硫的氧化性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气,
(1)检验氧气的存在,可根据氧气具有助燃性进行检验;
(2)干燥酸性气体二氧化硫选择浓硫酸,D中氢氧化钠溶液吸收剩余的二氧化硫,据此分析;
(3)C中固体产物的阴离子为亚硫酸根离子或者硫酸根离子,根据亚硫酸根离子与酸反应生成二氧化硫有漂白性,硫酸根与钡离子生成不溶于酸的白色沉淀分析;
(4)E中为硫化钠与二氧化硫发生价态归中反应,二氧化硫表现氧化性;F装置吸收二氧化硫,碱性减弱,红色变浅;
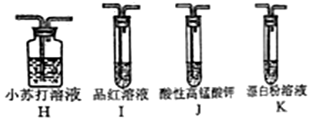
II、要证明H2SO3的酸性强于HClO,因为二氧化硫与次氯酸根离子发生氧化还原反应,不能直接通入漂白粉溶液中,应先用二氧化硫制备二氧化碳,再通入漂白粉中,证明酸性H2SO3>H2CO3>HClO,制备的二氧化碳中有二氧化硫,故通入漂白粉之前除去二氧化硫气体,D中品红不褪色,F中产生白色沉淀,能证明H2SO3的酸性强于HClO,据此分析.
解答 解:I、(1)检验SO2与Na2O2反应是否有氧气生成的方法是:将带火星的木条放在D试管口处,看木条是否复燃;
故答案为:将带火星的木条放在D试管口处,看木条是否复燃;
(2)装置B中试剂X干燥氯气,盛放试剂是浓硫酸,D中盛放NaOH溶液的作用是:吸收未反应的SO2,防止污染空气,二氧化硫与氢氧化钠反应生成亚硫酸钠和水,离子方程式为SO2+2OH-=SO32-+H2O(或者SO2+OH-=HSO3-),故阴离子为OH-、SO32-或(或SO32-或SO32-、HSO3-);
故答案为:浓H2SO4;OH-、SO32-或(或SO32-或SO32-、HSO3-);
(3)C中固体产物的阴离子为亚硫酸根离子或者硫酸根离,检验方法为:取少量固体滴加足量盐酸,产生气体能使品红褪色,则含SO32-; 再向溶液中滴加BaCl2溶液,产生白色沉淀,则含SO42-;
故答案为:取少量固体滴加足量盐酸,产生气体能使品红褪色,则含SO32-; 再向溶液中滴加BaCl2溶液,产生白色沉淀,则含SO42-;
(4)E中为硫化钠与二氧化硫发生价态归中反应生成硫单质,二氧化硫表现氧化性;F装置吸收二氧化硫,二氧化硫为酸性气体,F中碱性减弱,红色变浅;
故答案为:氧化性;溶液红色变浅;
II、(5)要证明H2SO3的酸性强于HClO,因为二氧化硫与次氯酸根离子发生氧化还原反应,不能直接通入漂白粉溶液中,证明酸性H2SO3>H2CO3>HClO即可:纯净的二氧化硫,通过H二氧化硫和水反应生成亚硫酸,亚硫酸和碳酸氢钠反应制取二氧化碳),制备的二氧化碳中有二氧化硫,故通入漂白粉之前除去二氧化硫气体(J用酸性高锰酸钾除去二氧化硫),再用品红检验二氧化硫是否除净(I用品红检验),再通入漂白粉中(K),K中的离子反应为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO;
故答案为:H→J→I→K;Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO;
(6)能证明H2SO3的酸性强于HClO的实验现象为I中品红不褪色,K中产生白色沉淀;
故答案为:I中的品红溶液不褪色,K中出现白色沉淀.
点评 本题考查了二氧化硫性质及检验,题目难度中等,注意掌握二氧化硫的化学性质及检验方法,正确分析题干信息为解答本题的关键,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 与金属反应时,稀HNO3被还原为NO,而浓HNO3被还原为NO2,故稀硝酸的氧化性强于浓硝酸 | |
| D. | 用10 mL量筒量取9.2 mL NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
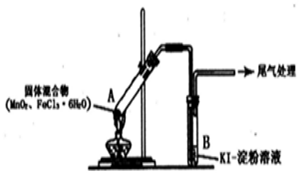
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验 序号 | 时间/min 浓度/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl
,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl .
. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量小 | |
| B. | 在镀件上电镀锌,可以用锌做阳极,也可以用惰性材料做阳极 | |
| C. | 二次电池充电过程是化学能转化为电能的过程 | |
| D. | 二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com