
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
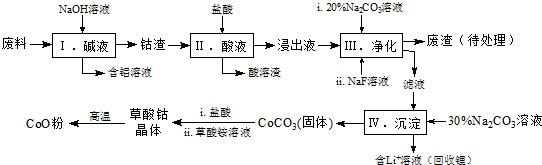
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol]. 分析 该工艺流程为:废料加入氢氧化钠溶液碱浸,得到钴渣,加入盐酸溶解后发生氧化还原反应,氧化钴氧化氯离子为氯气,过滤得到酸溶的溶液加入碳酸钠溶液和NaF溶液净化,除去锂离子和铁离子,在滤液中加入碳酸钠溶液沉淀钴离子为碳酸钴沉淀,加入盐酸和草酸铵溶液得到草酸钴晶体,高温分解得到氧化钴;
(1)步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气;
(2)Co2O3与盐酸反应生成Cl2,依据得失电子守恒结合原子个数守恒写成反应的离子方程式;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子;
(4)NaF与溶液中的Li+形成LiF沉淀,防止锂离子结合碳酸根离子形成碳酸锂沉淀;
(5)①计算晶体物质的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150℃~210℃固体质量变化=5.49g=4.41g=1.08g,说明210℃失去结晶水得到CoC2O4;
②210℃~290℃过程中是CoC2O4发生的反应,210℃~290℃过程中产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加反应的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.064g}{32g/mol}$=0.02mol,依据原子守恒配平书写反应的化学方程式.
解答 解:(1)步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co2O3与盐酸反应生成Cl2,反应中钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,依据得失电子守恒可知Co2O3的系数为1,Cl-的系数为2,结合原子个数守恒,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分除了LiF外还有Fe(OH)3;
故答案为:7.15;Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5))①计算晶体物质的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150℃~210℃固体质量变化=5.49g=4.41g=1.08g,说明210℃失去结晶水得到CoC2O4;
故答案为:失去结晶水;
②210℃~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.064g}{32g/mol}$=0.02mol,则:
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2
故答案为:3CoC2O4+2O2
点评 本题通过从某工业废料中回收钴的工艺流程考查了化学方程式、离子方程式书写,确各个阶段固体成分及先后分解生成物成分是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
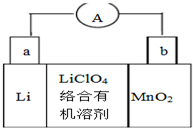 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
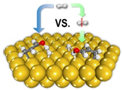 2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )
2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )| A. | 由氢原子构成的氢气分子只有一种 | |
| B. | 通常情况下,气体中氢气的密度最小 | |
| C. | 氢气可用于生产盐酸、氨气等化工产品 | |
| D. | 目前,工业上不采用电解水的方法大量生产氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
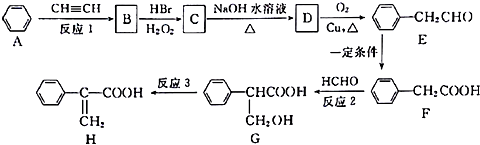
 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 100 mL 1 mol•L-1的H2SO4溶液中含有0.1NA个H+ | |
| C. | 将4 g NaOH溶于100 g蒸馏水中,所得溶液物质的量浓度是0.1 mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XQ2W分子在常温下呈气态,分子中的四个原子在同一平面内 | |
| B. | Z和W形成的两种离子化合物中阴、阳离子个数比均为2:1 | |
| C. | X、W两元素分别和Q元素化合,可形成电子数相同的两种化合物 | |
| D. | 相应的离子半径大小关系为:Y>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体硫酸氢钠,恢复原温度时,c(H+)增大,Kw变大 | |
| B. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 | |
| C. | 0.1 mol.L-1的醋酸溶液加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
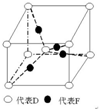 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小.
; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 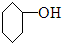 $\stackrel{浓H_{2}SO_{4}△}{→}$ $\stackrel{浓H_{2}SO_{4}△}{→}$ +H2O +H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaBr+H2O | |
| C. | 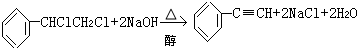 | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com