
科目:高中化学 来源:广东省中山一中2012届高三上学期第三次统测化学试题 题型:022
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应________.(填字母)
A.所需的活化能很高
B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g)
2NO(g)
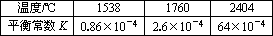
①该反应的ΔH________0.(填“>”、“=”或“<”)
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)
一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是________.A.降低温度
B.加催化剂
C.增加压强
D.增加O2浓度
E.分离出一氧化氮
(4)2404℃
时,在容积为1.0 L的密闭容器中通入2.6 mol N2和2.6 mol O2,计算反应N2(g)+O2(g)(5)
NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).且:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH=-534 kJ/mol
N2(g)+2H2O(g) ΔH=-534 kJ/mol
请写出肼与NO2反应的热化学方程式________.
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第7期 总第163期 人教课标版(选修4) 题型:022
在一定温度和压强下,有如下可逆反应:
2SO2(g)+O2(g)(1)达到平衡时混合气体的体积为________,SO2的转化率为________.
(2)若起始时加入a mol SO2、b mol O2,且a∶b=2∶1,在相同温度和压强下,反应达到平衡时,测得混合气体的容积为120 L.则a、b的值分别为:a=________,b=________.
(3)若为体积不变的密闭容器,其容积为100 L.起始时加入x mol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为________,x、z应该满足的关系式为________.
查看答案和解析>>
科目:高中化学 来源:江苏省扬中市高级中学2007-2008届一轮复习化学平衡 题型:022
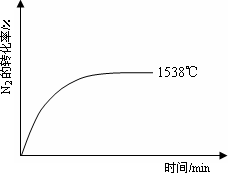
如图1,将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0.当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol.
2SO3(g);ΔH<0.当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol.
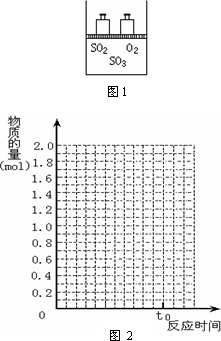
试回答:
(1)在图2中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线;
(2)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2(T2>T1),反应在t3时间时(t3>t1)重新达到平衡状态,新平衡混合物中气体的总物质的量________2.1 mol(填“<”、“>”或“=”).
(3)若起始时加入0.6 mol SO2、0.3 mol O2和x mol SO3,保持温度不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的值为________.
查看答案和解析>>
科目:高中化学 来源:江西省临川一中、新余四中2012届高三上学期期中考试化学试题 题型:022
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g);ΔH=a kJ·mol-1
2NO(g);ΔH=a kJ·mol-1
![]()
①该反应的△H________0
(填“>”、“=”或“<”).②其他条件相同时,在上述三个温度下分别发生该反应.
1538℃时,N2的转化率随时间变化如图所示,
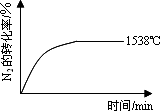
请补充完成1760℃时N2的转化率随时间变化的示意图.
(2)2404℃
时,在容积为1.0 L的密闭容器中通入2.6 mol N2和2.6 mol O2,计算反应N2(g)+O2(g)(3)
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.相应的热化学方程式如下:2N2(g)+6H2O(1)=4NH3(g)+3O2(g);ΔH=+1530 kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热ΔH=________.(用含a的代数式表示)
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2![]() 2NH3.则在电解法合成氨的过程中,
2NH3.则在电解法合成氨的过程中,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com