
| m |
| M |
| V |
| Vm |
| m |
| ρ |
| n |
| V |
| 1.56g |
| M |
| 0.04g |
| 2g/mol |
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| 36.5V |
| 22.4 |
100g+
| ||
| 1000ρg/L |
| 2240+36.5V |
| 22400ρ |
| ||
|
| 1000ρV |
| 2240+36.5V |
| 1000ρV |
| 2240+36.5V |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
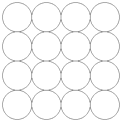 某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)
某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐溶液 | NaCl | Na2CO3 | NH4Cl、 | CH3COONa | Na2SO4 |
| PH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
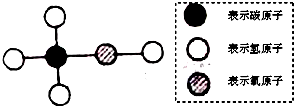
| A、甲醇的化学式为CH4O |
| B、甲醇的相对分子质量为32 |
| C、甲醇中C、H、O三种元素的质量比为1:4:1 |
| D、甲醇中氧元素的质量分数为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L NO2含有0.2nA个氧原子 |
| B、常温常压下,C2H4和C3H6组成的28g混合气体中含4NA个氢原子 |
| C、1 molC2H6分子中含有7NA个极性键 |
| D、常温下pH=13的NaOH溶液中含有的0.1 NA个OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com