
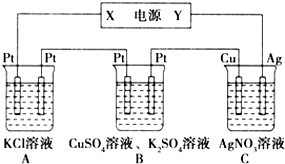
 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:分析 (1)C中铜电极质量增加,说明铜电极为阴极,则银电极为阳极,所以X为负极,Y为正极;
(2)A中为惰性电极电解KCl溶液,反应生成KOH、氯气与氢气;
B中阳离子首先是铜离子放电,阴离子是氢氧根放电,有氢离子生成;
C中为Cu上镀Ag,电解质溶液浓度不变;
(3)B中阳极只生成氧气,根据电子转移守恒计算氧气物质的量,再结合气体总体积计算阴极生气氢气物质的量,根据电子转移守恒计算CuSO4的物质的量,进而计算CuSO4的物质的量浓度;
(4)A中阴极发生反应:2H2O+2e-=H2↑+2OH-,根据电子转移守恒计算OH-的物质的量,进而计算OH-的物质的量浓度.
解答 解:(1)C中铜电极质量增加,说明铜电极为阴极,则银电极为阳极,所以X为负极,Y为正极,
故答案为:负极;
(2)A中为惰性电极电解KCl溶液,反应生成KOH、氯气与氢气,溶液呈碱性,pH增大;
B中阳离子首先是铜离子放电,阴离子是氢氧根放电,有氢离子生成,溶液pH减小;
C中为Cu上镀Ag,电解质溶液浓度不变,溶液pH不变,
故答案为:增大;减小;不变;
(3)C中Cu电极上析出Ag为$\frac{2.16g}{108g/mol}$=0.02mol,转移电子为0.02mol,由电子转移守恒可知B中阳极得到氧气为$\frac{0.02mol}{4}$=0.005mol,得到气体总物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,故阴极生气氢气为0.01mol-0.005mol=0.005mol,根据电子转移守恒可知CuSO4的物质的量=$\frac{0.02mol-0.005mol×2}{2}$=0.005mol,故CuSO4的物质的量浓度为$\frac{0.005mol}{0.2L}$=0.025mol/L,
故答案为:0.025mol/L;
(4)A中阴极发生反应:2H2O+2e-=H2↑+2OH-,根据电子转移守恒,生成OH-的物质的量为0.02mol,则OH-的物质的量浓度为$\frac{0.02mol}{0.2L}$=0.1mol/L,
故答案为:0.1mol/L.
点评 本题考查电解原理,侧重于学生的分析能力和计算能力的考查,把握离子的放电顺序为解答该题的关键,注意电子转移守恒在电化学计算中应用,难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I-可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50mL该溶液与过量Zn充分反应,生成0.56gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将3molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,溶液中一定含有3NA个NH4+ | |
| B. | 标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L | |
| C. | 10g质量分数为46%的乙醇水溶液中,氢原子的总数为1.2NA | |
| D. | 1L 1mol•L-1的碳酸钠溶液中钠离子的数目小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
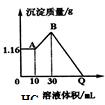 把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)
把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② |
| PH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-═Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的焰色呈黄色,说明该物质一定含有钠元素,不含钾元素 | |
| B. | 氧化钠和过氧化钠和酸均能反应生成盐和水,因此都是碱性氧化物 | |
| C. | 氧化钠和过氧化钠的阴阳离子比前者为1:2,后者为1:1 | |
| D. | 把过氧化钠投入滴有酚酞的水中,溶液先变红后褪色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 除去淀粉中NaCl杂质,可将混合物加水溶解后,用渗析的方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1的CH3COONa溶液中c(CH3COO-)=a mol•L-1,0.1mol•L-1的CH3COONa溶液中c(CH3COO-)=b mol•L-1,则有a=2b | |
| B. | 0.2mol•L-1的CH3COONa溶液与0.1mol•L-1的HCl溶液等体积混合,溶液显酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 相同物质的量浓度的下列溶液中,c(NH4+)由大到小的顺序:(NH4)2SO4>(NH4)2CO3>NH4Cl>NH4HCO3 | |
| D. | 0.1mol•L-1的HCN(弱酸)和0.1mol•L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)═c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com