
A.2NaCl(熔融)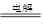 2Na+Cl2↑ 2Na+Cl2↑ | B.MgO+H2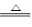 Mg+H2O Mg+H2O |
C.Fe2O3+3CO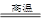 2Fe+3CO2 2Fe+3CO2 | D.2Ag2O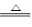 4Ag+O2↑ 4Ag+O2↑ |
科目:高中化学 来源:不详 题型:单选题
A.2AlCl3(熔融)  2Al+3Cl2↑ 2Al+3Cl2↑ |
B.MgO+H2 Mg+H2O Mg+H2O |
C.ZnO+CO  Zn+CO2 Zn+CO2 |
D.2CuO  2Cu+O2↑ 2Cu+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
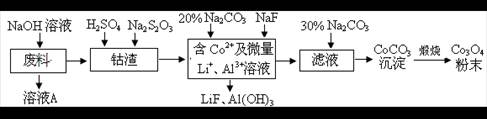
 LiF↓,该反应的平衡常数表达式为K= 。
LiF↓,该反应的平衡常数表达式为K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.海水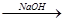 Mg(OH)2 Mg(OH)2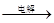 Mg Mg |
B.海水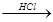 MgCl2溶液 MgCl2溶液 MgCl2熔融 MgCl2熔融 Mg Mg |
C.海水 Mg(OH)2 Mg(OH)2 MgO MgO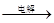 Mg Mg |
D.海水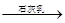 Mg(OH)2 Mg(OH)2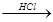 MgCl2溶液 MgCl2溶液 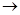 MgCl2熔融 MgCl2熔融 Mg Mg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

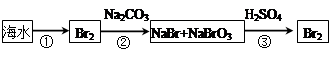

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
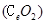 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含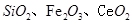 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: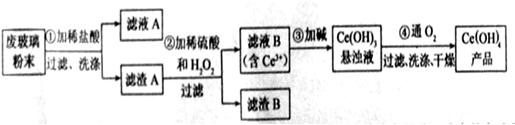

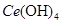 产品0.536g,加硫酸溶解后,用0.1000mol?
产品0.536g,加硫酸溶解后,用0.1000mol? 溶液(铈被还原为
溶液(铈被还原为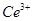 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中 的质量分数为 。
的质量分数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(1)(3)(4)(5) | B.(2)(3)(5)(6) | C.(3)(4)(5)(6) | D.(1)(2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硅可以用来制造光导纤维 | B.工艺师利用盐酸刻蚀石英制作艺术品 |
| C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 | D.粗硅制备单晶硅不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
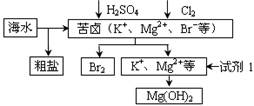
| A.可用BaCl2溶液除去粗盐中的SO42- |
| B.从苦卤中提取Br2的反应的离子方程式为:2Br- + Cl2 ="=" 2Cl- + Br2 |
| C.试剂1可以选用石灰乳 |
| D.工业上,电解熔融Mg(OH)2冶炼金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com