
【题目】回答下列关于铁元素及其化合物的知识:
(1)将 NaOH 溶液滴入 FeSO4溶液中,能观察到的现象是___,请写出产物颜色变化时发生的反应方程式___。
(2)实验室配制氯化铁溶液时,通常应将氯化铁固体溶解在加有少量 ___的水中; FeCl2溶液在空气中放置一段时间后,逐渐变成浅黄色,其原因是___。(用离子方程式表示)
(3)在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。该反应的化学方程式_________________,该反应中的还原剂是___,氧化剂是___。
(4)在 100mL18mol/L的浓硫酸中加入过量的铁片,加热使之充分反应,产生的气体在标准状况下的体积可能是 ___。
A.40.32L B.25.76L C.20.16L D.6.72L
【答案】先产生白色沉淀,并逐渐变成灰绿色,最后变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 浓盐酸 4Fe2++4H++O2=4Fe3++2H2O 3Fe+4H2O(g)![]() Fe3O4+4H2 Fe H2O B
Fe3O4+4H2 Fe H2O B
【解析】
(1)硫酸亚铁和氢氧化钠发生反应生成氢氧化亚铁沉淀,易被氧化为氢氧化铁;
(2)氯化铁固体直接溶解在水中易水解,需要加入酸抑制铁离子水解;Fe2+在空气中易被氧化;
(3)铁与水蒸气在加热条件下发生氧化还原反应生成四氧化三铁和氢气;
(4)根据铁能和浓硫酸反应硫酸铁和二氧化硫,能和稀硫酸反应生成硫酸亚铁和氢气判断。
(1)硫酸亚铁和氢氧化钠发生反应生成氢氧化亚铁白色沉淀,该白色沉淀易被氧化为氢氧化铁红褐色沉淀,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(2)氯化铁固体溶解在较浓的盐酸中,可抑制铁离子水解,再加水稀释;Fe2+有较强的还原性,则FeCl2溶液在空气中放置一段时间后,逐渐变成浅黄色,是Fe2+在空气中易被氧化为Fe3+的缘故,发生反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O;
(3)铁与水蒸气发生氧化还原反应:3Fe+4H2O(g)![]() Fe3O4+4H2,根据化合价升降来判断氧化剂和还原剂.因铁的化合价升高,所以铁作还原剂,水中氢的化合价降低,水作氧化剂;
Fe3O4+4H2,根据化合价升降来判断氧化剂和还原剂.因铁的化合价升高,所以铁作还原剂,水中氢的化合价降低,水作氧化剂;
(4)浓硫酸的物质的量为0.1L×18mol/L=1.8mol,若只发生2Fe+6H2SO4![]() Fe2(SO4)3+3SO2↑+6H2O,生成的SO2的物质的量应为0.9mol,则V(SO2)=0.9mol×22.4L/mol=20.16L;随着反应的进行,Fe和稀硫酸反应,若只发生Fe+H2SO4
Fe2(SO4)3+3SO2↑+6H2O,生成的SO2的物质的量应为0.9mol,则V(SO2)=0.9mol×22.4L/mol=20.16L;随着反应的进行,Fe和稀硫酸反应,若只发生Fe+H2SO4![]() FeSO4+H2↑,参加反应的硫酸为1.8mol,则生成的H2的物质的量为1.8mol,其体积V(H2)=1.8mol×22.4L/mol=40.32L,实际生成的气体体积应为二者之间,故答案为B。
FeSO4+H2↑,参加反应的硫酸为1.8mol,则生成的H2的物质的量为1.8mol,其体积V(H2)=1.8mol×22.4L/mol=40.32L,实际生成的气体体积应为二者之间,故答案为B。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】牛至是一种质地坚硬、树枝茂密的多年生药草。从牛至精油中提取的三种活性成分的结构简式如图所示。下列说法错误的是( )

A.a、b、c均能发生加成反应和取代反应
B.b分子存在属于芳香族化合物的同分异构体
C.c分子中至少有8个碳原子共面
D.完全燃烧1mol三种物质时,消耗氧气的量a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
将浸透了石蜡油的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面,发生反应后将得到的气体混合物通入盛有某试剂的试管中加以验证(装置如图所示)。

回答下列问题:
(1)决定乙烯性质的官能团是______________。
(2)验证该气体混合物中含有乙烯的实验方案是______________________________。
(3)验证该气体混合物中含有乙烯的实验现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解饱和 NaCl 溶液的实验装置,x、y 都是惰性电极,a 是饱和 NaCl 溶液,同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是

A.x 电极为阳极,y 电极为阴极
B.x 电极附近溶液变红色,且有刺激性气味气体产生
C.若将两电极产生的气体收集起来,X电极得到的气体与Y电极得到的气体之比之比略大于 1:1
D.电解后,将溶液混匀,电解前后溶液的 pH 未发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1 的溶液中:HCO![]() 、SO
、SO![]() 、K+、Cl-
、K+、Cl-
B.遇酚酞变红的溶液中:NO![]() 、Na+、、SiO
、Na+、、SiO![]() 、K+
、K+
C.c(NO![]() ) = 1 mol·L -1 的溶液中:H+、Fe2+、Cl-、NH
) = 1 mol·L -1 的溶液中:H+、Fe2+、Cl-、NH![]()
D.无色透明溶液中: K+、SO![]() 、Na+、MnO
、Na+、MnO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其消毒后被还原为Fe(OH)3;又可以有净水的功能,是一种无二次污染的绿色水处理剂。工业上制备方法有:①湿法:次氯酸盐氧化法②干法:高温过氧化物法。
(1)湿法制备的主要反应方程为Fe(OH)3+KClO+KOH=K2FeO4+KCl+H2O,配平上述反应化学方程式___。
(2)干法制备中牵涉到的物质有:FeSO4、K2FeO4、K2SO4、K2O2,将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目___。
(3)制备相同质量 K2FeO4 时转移的电子数,湿法制备 ___干法制备(填“>” “<”或“=”)。
(4)高铁酸钾和二氧化氯(其还原产物为 Cl—)都是高效杀菌消毒剂,但消毒效率(单位质量转移的电子数)是不相同的,则高铁酸钾的效率是二氧化氯的___倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,将nmol·L-lCH3COOH溶液滴入10mL1.0mol·L-1NaOH溶液中,溶液pH和温度随加入CH3COOH溶液体积变化曲线如图所示,下列有关说法正确的是

A. Kw:a>bB. 25℃时:K( CH3COOH)=1/(n-1) 10-7
C. n<1.0D. 水的电离程度:c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物X、Y的说法不正确的是( )
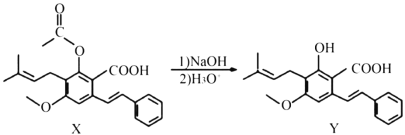
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙酸发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下,X、Y分别与足量Br2加成的产物分子中的手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的化工原料,用途非常广泛。
实验一:SO2可以抑制细菌滋生,具有防腐功效。某实验小组欲用下图所示装置测定某品牌葡萄酒中(葡萄酒中含有乙醇、有机酸等)的SO2含量。
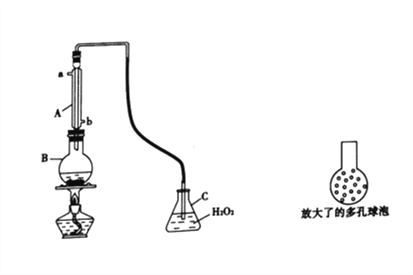
(1)仪器A的名称是________;使用该装置主要目的是____________________。
(2)B中加入 300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中化学方程式为_________________________________________。
(3)将输入C装置中的导管顶端改成具有多孔的球泡(如图15所示)。可提高实验的准确度,理由是_______________________________________。
(4)除去C中的H2O 然后用0.099mol·L-1NaOH标准溶液滴定。
①用碱式滴定管量取0.09mol·L-1NaOH标准溶液前的一步操作是___________________________;
②用该方法测定葡萄酒中SO2的含量偏高,主要原因是__________________________________,利用现有的装置,提出改进的措施是_______________________________________________。
(5)利用C中的溶液,有很多实验方案测定葡萄酒中SO2的含量。现有0.1mol·L-1BaCl2溶液,实验器材不限,简述实验步骤:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com