
 .
. 、
、 .
.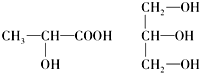
分析 (1)根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
(2)配合物中含有空轨道的金属阳离子为中心离子,有孤对电子的原子或离子为配体,配位数就是配体的个数;
(3)计算BCl3分子的中心原子B的价层电子对数,确定VSEPR模型和空间构型,杂化轨道数目和类型、根据空间构性确定键角;
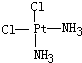
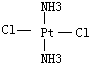
(4)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置;
(5)连接4个不同原子或原子团的碳原子为手性碳原子.
解答 解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,Mg2+含有的核外电子数为12-2=10个,核外电子排布式为1s22s22p6,电子排布图为 ,
,
故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2; ;
;
(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)BCl3分子的中心原子B的价层电子对数=3+$\frac{1}{2}$(3-3×1)=3,孤电子对数为0,因此空间构型和VSEPR模型一致,为平面正三角形,因此键角为120°,杂化类型为sp2杂化,
故答案为:平面正三角形;sp2;120°;
(4)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置,故答案为: 、
、 ;
;
(5)手性碳原子连接四个不同的原子或原子团,前者有手性碳原子,后者没有,故答案为: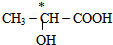 .
.
点评 本题考查了核外电子排布式(图)、配合物和分子结构、杂化等知识,题目难度中等,熟练掌握原子核外电子排布规律、价层电子对互斥理论和轨道杂化理论是解题的关键.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
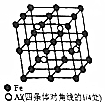 铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: .
. ,C、N、O三种元素的电负性由大到小的顺序为O>N>C.
,C、N、O三种元素的电负性由大到小的顺序为O>N>C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的平均消耗速率为0.3mol/(L•min) | |
| B. | 升高温度时,v正减小,v逆增大 | |
| C. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| D. | 平衡后,增大压强,平衡将向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和石灰水、NaOH溶液 | B. | Na2CO3溶液、AgNO3溶液 | ||
| C. | NaHCO3溶液、饱和食盐水 | D. | 氨水、石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
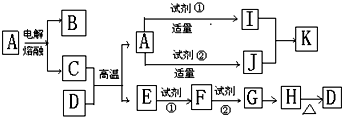
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
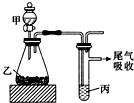 用如图装置进行实验,下列所得结论正确的是( )
用如图装置进行实验,下列所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “接触法”制H2SO4时,催化氧化阶段的反应原理为:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0 | |
| B. | 海水提镁的主要步骤为:海水$\stackrel{CaCO_{3}(s)}{→}$Mg(OH)2(s)$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg(l)+Cl2(g) | |
| C. | 普通水泥的主要成分是硅酸钙 | |
| D. | 黏土的主要成分是三氧化二铝. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用聚二氧化碳塑料会产生白色污染 | |
| B. | 聚二氧化碳塑料是通过聚合反应制得的 | |
| C. | 聚二氧化碳塑料与干冰互为同分异构体 | |
| D. | 聚二氧化碳塑干冰都属于纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com