
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为___。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:NaCl+H2O电解NaClO3+ 。___。
②II中转化的基本反应类型是___,该反应过程能析出KClO3晶体而无其它晶体析出的原因是___。
(4)一定条件,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。

①D是___(填离子符号)。
②B→A+C反应的离子方程式为___。
【答案】![]() bc NaCl+3H2O=NaClO3+3H2↑ 复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ClO4- 3ClO-=ClO3-+2Cl-
bc NaCl+3H2O=NaClO3+3H2↑ 复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ClO4- 3ClO-=ClO3-+2Cl-
【解析】
(1)与氯元素同族的短周期元素是氟元素,其原子结构示意图为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)元素非金属性强弱判断方法:①与H2化合越容易,气态氢化物越稳定,非金属性越强,②单质的氧化性越强或阴离子的还原性越弱,非金属性越强,③最高价氧化物对应水化物的酸性越强,非金属性越强,与物质的沸点、氢化物水溶液的酸性无关,则bc符合题意,故答案为:bc;
(3)①电解时,阳极上Cl-放电生成ClO3-,阴极上H+放电生成H2,故反应方程式为NaCl+3H2O=NaClO3+3H2↑,故答案:NaCl+3H2O=NaClO3+3H2↑;
②NaClO3转化为KClO3,说明该反应中两种物质互相交换离子生成盐,为复分解反应;相同温度下,溶解度小的物质先析出。室温下,KClO3在水中的溶解度小于其他晶体,所以先析出KClO3,故答案为:复分解反应;室温下,KClO3在水中的溶解度明显小于其他晶体;
(4)①根据图象可知,D中Cl元素的化合价为+7价,所以ClOx-中的x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据图像可知为:ClO-→Cl-+ClO3,根据电子守恒可知该反应方程式为:3ClO =2Cl +ClO3,故答案为:3ClO-=ClO3-+2Cl-。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】铁、钴(Co)属于第四周期第VIII族元素,含铁、钴化合物具有诸多用途。回答下列问题:
(1)基态Co原子价层电子的电子排布图(轨道表达式)为________________。
(2)Co的配合物[Co(NH3)5Cl]SO4是一种重要的化合物。
①SO42-的空间立体构型为___________,其中S原子的杂化轨道类型是___________,写出一种与SO42-互为等电子体的分子的化学式:______________。
②[Co(NH3)5Cl]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_______________。
③[Co(NH3)5Cl]SO4中,存在___________(填字母)
a.离子键 b.金属键 c.配位键 d.非极性键 e.极性键
(3)铁氰化钾{K3 [Fe(CN)6]}溶液是检验Fe2+常用的试剂。
①1mol [Fe(CN)6]3-含![]() 键的数目为__________。
键的数目为__________。
②CN-能与多种离子形成配合物,碳原子提供孤电子对,而不是氮原子,其原因是____________。
③FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______gcm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为_________nm。
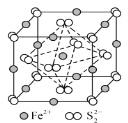
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
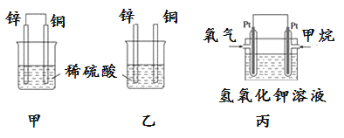
①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.甲乙两烧杯中溶液的 pH 均增大
②同条件下两烧杯中产生同体积的气体,需要的时间甲________乙(填“>”“<”或“=”)。
③请写出甲乙图中构成原电池的负极电极反应式:__________________。
④当甲中溶液质量增重15.75g时,电极上转移电子数目为______________。
(2) 图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。写出负极的电极反应方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、P、S、Cl、Cu、Zn八种元素的单质及化合物在现代工业生产中有着广泛的应用,请回答下列问题:
(1)第一电离能:Zn_______Cu(填“>”或“<”下同)电负性S ______Cl。
(2)写出基态Cu原子的价电子排布式_________________
(3)SO3的空间构型是________________ ,白磷P4分子呈正四面体结构,P原子位于正四面体的四个顶点,则P原子的杂化形式为_________________。
(4)与SCN—互为等电子体的微粒有_________________________(任写两种)。
(5)NH3、PH3、AsH3三者的沸点由高到低的顺序是___________,原因是______________。
(6)Cu与Cl形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
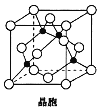
①该晶体的化学式为_________。
②已知该晶体中Cu原子和Cl氯原子之间的最短距离apm且恰好为体对角线的![]() ,阿伏伽德罗常数为NA,则该晶体的密度为__________________g/cm3(列出计算式即可)。
,阿伏伽德罗常数为NA,则该晶体的密度为__________________g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
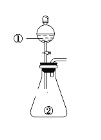
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液(H2C2O4具有还原性) | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
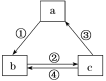
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Si | SiO2 | H2SiO3 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | Fe | FeCl3 | FeCl2 | ④加入氯气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁红涂料中添加有CuO或FeO中的一种,为探究添加物的成分设计如下实验方案。
(1)请写出实验步骤、预期现象,对应的离子方程式。
(限选试剂:铁粉、3mol/LH2SO4、0.1mol/L酸性KMnO4溶液、10%H2O2、KSCN溶液)

①_____________,②_____________,_____________,③___________,_____________
④操作步骤③中反应的离子方程式为____________。
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验。
已知:气体由草酸晶体受热分解得到:H2C2O4·2H2O ![]() CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。
CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。

①装置A、B中的试剂依次是_____、______。
②气体通入后,接下来的操作是____,然后对C装置加热。
③实验前后称得D装置增重8.8g,则此铁红中铁的质量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是______________________________。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C.KNO3溶液 D.Na2SO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
③2min内Y的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在含氯物质的制取、含量测定等方面有重要的作用。
⑴将一定量的氯气通入过量NaOH溶液中,由于副反应的存在,溶液中同时存在Cl-、ClO-和ClO3-。若Cl-、ClO-和ClO3-的物质的量分别为a mol、b mol和c mol,根据电子得失守恒可知a、b、c之间一定存在的等量关系是______。
⑵工业次氯酸钠溶液中含有氯酸钠会影响产品质量。测定次氯酸钠样品中的氯酸钠含量的过程如下:
步骤Ⅰ:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将ClO-完全还原成Cl-(ClO3-在该条件不与H2O2反应),加热煮沸,冷却至室温,加入硫酸至酸性,
步骤Ⅱ:向步骤Ⅰ所得溶液中加入0.1000 mol·L-1硫酸亚铁溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点,消耗该溶液20.00 mL。
已知步骤Ⅱ中涉及的相关反应转化为:ClO3-![]() Cl-,Cr2O72-
Cl-,Cr2O72-![]() Cr3+,则碱性NaClO溶液试样中所含NaClO3的物质的量浓度为______mol·L-1。
Cr3+,则碱性NaClO溶液试样中所含NaClO3的物质的量浓度为______mol·L-1。
⑶NaClO2广泛用于造纸工业、污水处理等,可由ClO2为原料反应制得。某溶液X中同时含有ClO2和NaClO2,为测定其中ClO2-的浓度,现进行如下实验:
步骤1:量取25.00 mL溶液X,调节溶液的pH为8.0,加入足量的KI晶体(发生反应:2ClO2+2I-=2ClO2-+I2)。滴入2滴淀粉溶液,滴加0.02000 mol·L-1Na2S2O3溶液(发生反应:2Na2S2O3+I2=Na2S4O6+2NaI)。恰好完全反应时,消耗Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0(发生反应:ClO2-+4H++4I-=Cl-+2I2+2H2O),滴加0.2500 mol·L-1Na2S2O3溶液。恰好完全反应时,消耗Na2S2O3溶液40.00 mL。请计算溶液X中ClO2-的物质的量浓度(写出计算过程)。_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com