
| A. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 | |
| B. | 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1盐酸与0.2mol•L-1氨水等体积混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
分析 A.醋酸是弱电解质,加水稀释时促进醋酸电离,稀释10倍后,氢离子浓度大于原来的$\frac{1}{10}$;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.0.1mol•L-1盐酸与0.2mol•L-1氨水等体积,溶液中溶质为等物质的量浓度的NH3•H2O和NH4Cl,NH3•H2O电离程度大于铵根离子水解程度导致溶液呈碱性,但NH3•H2O电离程度较小;
D.AgCl溶解度大于AgI.
解答 解:A.醋酸是弱电解质,加水稀释时促进醋酸电离,稀释10倍后,氢离子浓度大于原来的$\frac{1}{10}$,所以a>b-1,故A错误;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)],故B正确;
C.0.1mol•L-1盐酸与0.2mol•L-1氨水等体积,溶液中溶质为等物质的量浓度的NH3•H2O和NH4Cl,NH3•H2O电离程度大于铵根离子水解程度导致溶液呈碱性,但NH3•H2O电离程度较小,所以离子浓度大小顺序是c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故C错误;
D.AgCl溶解度大于AgI,所以离子浓度大小顺序是c(Ag+)>c(Cl-)>c(I-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意弱电解质电离特点,注意:任何电解质溶液中都存在电荷守恒和物料守恒,与溶质种类多少及溶解度无关,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2 | |
| B. | 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 | |
| C. | 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O | |
| D. | 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
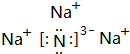 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
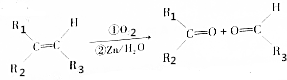
 和
和 各1mol.
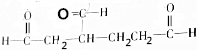
各1mol.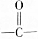 ),产物与烃分子中原子个数相等的元素有C、H.
),产物与烃分子中原子个数相等的元素有C、H. 可简写为
可简写为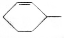 ,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足.写出A所有可能的结构简式:
,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足.写出A所有可能的结构简式: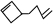 、
、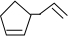 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比[n(NO2):n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
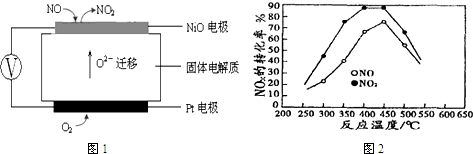
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 简单气态氢化物的热稳定性:B>E | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com